Uma proteína pode ser desnaturada por ação de alguns fatores externos, como, por exemplo, o calor, um meio altamente ácido ou a influência de um metal pesado. Para todos os procedimentos descritos abaixo, pode-se utilizar como solução de proteína a clara do ovo diluída em água.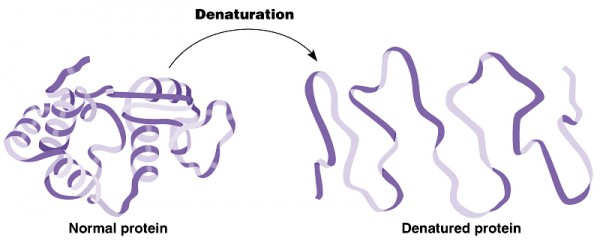
Conteúdo deste artigo
Precipitação por ação do calor
Em um tubo de ensaio colocar 2 mL de solução de proteína e aquecer diretamente na chama se agitar. Observar a formação de coágulo brando de proteína desnaturada.
Explicação: O calor desnatura (precipita) as proteínas, transformando-as em proteínas que são insolúveis por modificação na sua estrutura.
Precipitação por ação de ácidos
Reação de Heller
Em um tubo de ensaio colocar 1mL de HNO3 concentrado e cuidadosamente pelas paredes do tubo 1mL de solução de proteína, tendo o cuidado para as soluções não se misturarem. Na junção da camada dos dois líquidos se forma um anel branco de albumina precipitada. Outros ácidos fortes como o HCl e H 2SO 4 também dão testes positivos com a albumina. Repetir técnica utilizando o ácido clorídrico, e anotar diferenças.
Explicação: Os ácidos fortes desnaturam (precipitam) as proteínas, transformando-as em meta proteínas que são solúveis.
Precipitação por sais de metais pesados
Em 3 tubos de ensaio colocar respectivamente 2mL de solução de proteína: no tubo 1 colocar 5 gotas de solução de HgCl2 a 0,5%, no tubo 2 colocar 5 gotas de solução de AgNO3 a 0,5% e no tubo 3 colocar 5 gotas de solução de CuSO4 a 0,5%. Em todos os tubos forma-se um precipitado branco
Explicação: Em pH situado do lado alcalino do seu ponto isoelétrico, algumas proteínas combinam-se com cátions de metais pesados formando proteinatos insolúveis. Os sais de metais pesados reagem com seu cátion com o ânion da proteína (COO-) formando proteinatos, no caso de mercúrio de prata e de cobre, estes proteinatos são insolúveis e por isso precipitam.
Precipitação por ação de solventes orgânicos
Em um tubo de ensaio colocar 1mL de solução de proteínas e álcool etílico (1 a 3 volumes) até a formação de precipitado de proteínas.
Explicação: A adição de solventes orgânicos como o etanol, éter dietílico e acetona, quando adicionado às soluções aquosas de proteínas, podem levar à precipitação das mesmas.
Precipitação por reação com agentes alcalóides
Em um tubo de ensaio colocar 1ml de solução albumina de ovo e adicionar 1mL de ácido tricloroacético a 10% (TCA). Observar a formação de um precipitado branco de proteínas desnaturadas.
Explicação: A adição de ácidos orgânicos favorece a precipitação de uma proteína quando em meio aquoso.
Leia também:
- Síntese de Proteínas
- Funções das Proteínas
- Composição química das Proteínas
- Procedimentos para identificação de Proteínas
- Desnaturação
Referências:
ATKINS, Peter; JONES, Loreta; Princípios de Química: questionando a vida moderna e o meio ambiente, Porto Alegre: Bookman, 2001.
MAHAN, Bruce M.; MYERS, Rollie J.; Química: um curso universitário, Ed. Edgard Blucher LTDA, São Paulo/SP – 2002.
Ilustração: http://foodslashscience.blogspot.com.br/2010/11/cooking-meat-thermodynamics-and.html
Texto originalmente publicado em https://www.infoescola.com/bioquimica/tecnicas-de-desnaturacao-de-proteinas/