Os proteassomos estão presentes no citoplasma e núcleo das células eucarióticas, ou seja, em todas as células de animais e vegetais até o momento estudados, além de certos seres primitivos, conhecidos como arqueobactérias. Desempenham importante função na fisiologia celular, mais precisamente na regulação da divisão celular.
São definidos como complexos de diversas proteases, que digerem proteínas endógenas, ou seja, sintetizadas dentro das células. Esse grande complexo proteolítico é capaz de hidrolisar as ligações peptídicas existentes nas proteínas, promovendo a sua degradação e, assim alterando a organização das células.
Estrutura e atividade
Em 1942, Schoenheimer utilizando de marcação radioisotópica, verificou que proteínas são constantemente sintetizadas e degradadas no interior das células. Posteriormente, a arquitetura molecular dos proteassomos foi determinada por Baumeister, através de tomografia eletrônica e cristalografia de raios X. Após a descoberta, se constatou a importância da ação desse complexo enzimático na regulação da divisão celular.
A ação do proteassomo é dependente de ATP, pois necessita de energia para destruir as proteínas e, também é específica, pois essas proteínas se encontram marcadas para a destruição. A degradação dessas proteínas é importante para que não ocorra o excesso de enzimas e outras proteínas no interior das células. Também, a ação visa destruir proteínas com erros de síntese ou danificadas, bem como as proteínas codificadas por vírus, pois seriam usadas na fabricação de novos vírus.
O retículo endoplasmático (RE) possui um sistema de vigilância para proteínas que apresentam falhas no enovelamento. A função biológica de uma proteína é determinada pelo seu correto enovelamento, onde ao se dobrar e enrolar, assume a sua forma tridimensional específica. O RE é capaz de detectar falhas nesse processo e transportar essas proteínas para o citoplasma, onde serão degradadas pelo proteassomo.
A ação dos proteassomos difere dos lisossomos em alguns aspectos, já que os lisossomos não consomem energia para a degradação proteica e, a atividade dos proteassomos se faz de forma individualizada sobre as proteínas, enquanto os lisossomos agem sobre todo um material introduzido na célula, ou age sobre organelas.
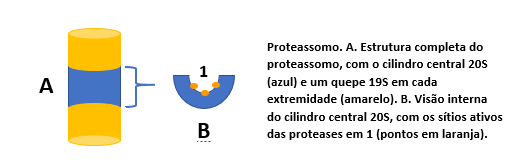
Os proteassomos são estruturas proteicas grandes, em formato de um barril constituído por quatro anéis sobrepostos. O cilindro central é oco, chamado proteassomo central 20S, onde várias subunidades de proteínas se associam, formando um tubo de quatro anéis heptaméricos. Algumas dessas subunidades são enzimas, onde se encontram os sítios ativos das proteases, voltadas para a face interna do cilindro, o que impede o proteassomo de atuar de forma descontrolada sobre a célula. Em cada extremidade desse cilindro há um grande complexo proteico, chamado de capa ou quepe 19S, que contém um anel proteico por onde as proteínas-alvo são introduzidas e chegam ao proteassomo central, onde são degradadas. Esta complexa estrutura garante que o substrato, uma vez ligado ao proteassomo, se mantenha ligado até que seja completamente degradado e convertido a pequenos peptídeos.
Sistema ubiquitina-proteassomo
Se o proteassomo central 20S é o núcleo proteolítico, o quepe 19S funciona como um portão do núcleo, onde apenas as proteínas marcadas para a destruição podem entrar. Esta marcação é feita através da ligação covalente com uma pequena proteína denominada ubiquitina, composta por 76 aminoácidos.
Neste mecanismo, a molécula de ubiquitina se liga a um resíduo do aminoácido lisina, na proteína a sofrer a degradação e, outras moléculas de ubiquitina acabam por se ligar à primeira, formando um complexo que pode ser reconhecido pelo quepe 19S. A molécula proteica é então conduzida ao núcleo proteolítico, com consumo de ATP, onde se liga no sítio ativo e é degradada em peptídeos com aproximadamente oito aminoácidos cada, e devolvidos ao citoplasma. Esses peptídeos podem ser degradados por enzimas presentes no citoplasma ou sofrer outros destinos. Já as moléculas de ubiquitina envolvidas no processo são liberadas, para que possam ser utilizadas novamente.
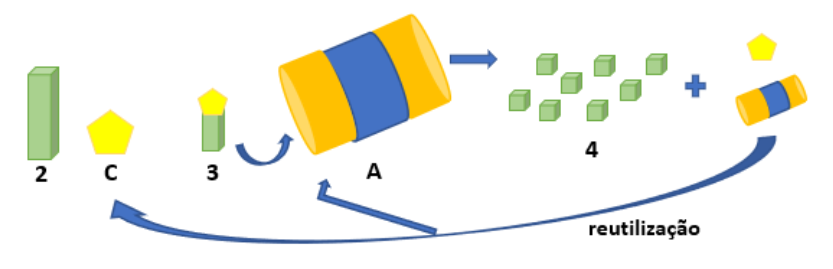
Sistema ubiquitina-proteassomo. 2: Proteína a sofrer degradação. C: Ubiquitina. 3: Proteína marcada com ubiquitina é reconhecida pelo proteassomo. 4: Proteína degradada, com a formação de peptídeos é devolvida ao citoplasma; molécula de ubiquitina e proteassomo são liberados e reutilizados.
Bibliografia:
ALBERTS, Bruce et al. Biologia molecular da célula. 6. ed. Porto Alegre: Artmed, 2017.
WIDER, M.C. Papel fisiológico do proteassomo 20S livre sob revisão crítica. Disponível em http://redoxoma.iq.usp.br/paginas_view.php?idPagina=935#.Xd7pXuhKjIU.
SILVA, Elisabete Rodrigues do Monte. Caracterização do repertório peptídico intracelular de células expressando o proteassomo imune. 2014. Dissertação (Mestrado em Biologia Celular e Tecidual) - Instituto de Ciências Biomédicas, University of São Paulo, São Paulo, 2014. doi:10.11606/D.42.2014.tde-26062014-184010. Acesso em: 2019-11-27.
Texto originalmente publicado em https://www.infoescola.com/citologia/proteassomo/