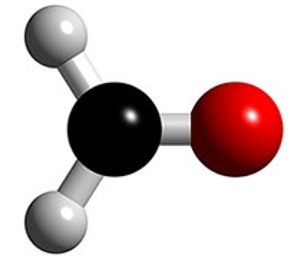
A função orgânica aldeído é caracterizada pela presença de um grupo (–CHO), chamado aldoxila. Dentre o vasto número de compostos dessa natureza, aquele de menor peso molecular possível, recebe o nome de aldeído fórmico, de formaldeído ou de formol, e apresenta nomenclatura oficial, segundo a IUPAC, de metanol. A fórmula molecular desse aldeído é HCHO. Sua fórmula estrutural é mostrada abaixo, na qual pode ser observada sua polaridade, uma vez que a região do átomo de oxigênio polariza a carga negativa da molécula.
 O formaldeído é um gás incolor nas Condições Normais de Temperatura e Pressão (CNTP), apresenta odor irritante e elevada hidrossolubilidade, sendo também solúvel na maior parte dos solventes orgânicos mais corriqueiros, o que pode ser explicado devido à sua polaridade. Em solução aquosa, que atinge uma concentração máxima de 40% (40g do composto para cada 100g de solução), possui o nome usual de formol ou formalina. Pode se converter um uma nuvem de vapor a baixas temperaturas e é facilmente oxidável pela ação da luz ou do ar atmosférico.
O formaldeído é um gás incolor nas Condições Normais de Temperatura e Pressão (CNTP), apresenta odor irritante e elevada hidrossolubilidade, sendo também solúvel na maior parte dos solventes orgânicos mais corriqueiros, o que pode ser explicado devido à sua polaridade. Em solução aquosa, que atinge uma concentração máxima de 40% (40g do composto para cada 100g de solução), possui o nome usual de formol ou formalina. Pode se converter um uma nuvem de vapor a baixas temperaturas e é facilmente oxidável pela ação da luz ou do ar atmosférico.
O aldeído fórmico foi descoberto acidentalmente em 1867 pelo químico alemão Hoffmann, e ainda hoje é sintetizado pelo mesmo método da oxidação utilizado por Hoffmann: a oxidação catalítica do metanol.
Soluções desse composto de concentração maior de 40% levam a um polímero que precipita sob a forma de um sólido branco pulverizado, conhecido como trioximetileno ou metaformaldeído, propriedade essa que deu origem a algumas de suas aplicações industriais.
A partir de soluções muito diluídas possui aplicação doméstica como desinfetante forte devido a seu efeito bactericida. Entretanto, “o formol é tóxico quando ingerido, inalado ou quando entra em contato com a pele, por via intravenosa, intraperitoneal ou subcutânea. Em concentrações de 20 ppm (partes por milhão) no ar causa rapidamente irritação nos olhos. Sob a forma de gás é mais perigoso do que em estado de vapor”1.
Em relação à sua excreção do organismo humano, observa-se que “devido à rápida conversão do formaldeído a ácido fórmico e a sua subsequente incorporação nos constituintes celulares, a excreção não aparenta ser um factor de toxicidade do formaldeído. O metabolismo do formaldeído a ácido fórmico ocorre em todos os tecidos do organismo como consequência da formação endógena de formaldeído.”2
Na indústria possui aplicação como matéria prima de polímeros fenólicos, como o baquelite e a fórmica. Contudo, talvez a mais popular aplicabilidade do formol esteja em sua utilização no embalsamamento de peças e cadáveres, uma vez que proporciona firmeza a tecidos orgânicos e, como já fora mencionado, apresenta ação germicida. Aplicações industriais menos conhecidas são a confecção de borrachas sintéticas, o processo de endurecimento da gelatina e a síntese de algumas drogas e pesticidas.
Referências:
1. http://www1.inca.gov.br/conteudo_view.asp?ID=795
2. Agency for Toxic Substances and Disease Registry (ATSDR), Toxicological Profile for Formaldehyde, U.S. Department of Health and Human Services, Public Health Services, 1999.
RUSSELL, John B.; Química Geral vol.2, São Paulo: Pearson Education do Brasil, Makron Books, 1994.
Texto originalmente publicado em https://www.infoescola.com/compostos-quimicos/aldeido-formico/