A nitroglicerina é um líquido oleoso de coloração amarela levemente esverdeada, semelhante ao mel, foi utilizada como explosivo devido a sua instabilidade, e capacidade de liberação de moléculas de gases, possui massa molecular de 227 g mol-1, e sua temperatura não deve ultrapassar os 30°C, nem ser exposta a choques mecânicos.
A nitroglicerina foi descoberta pelo cientista italiano Ascanio Sobrero, e por observar as perigosas propriedades apresentadas pelo líquido, concluiu que isto representava um empecilho para sua comercialização. Porém o professor Zinin da Universidade russa de São Petersburgo sugeriu ao químico Alfred Nobel que aplicasse a nitroglicerina como explosivo; no ano de 1863, este obteve a primeira patente do explosivo.
O composto mostrou ser superior a qualquer explosivo existente, e a prova disso foi a explosão de 1864 que destruiu completamente a fábrica de Nobel e matou seu irmão. Diante desta tragédia o cientista , começou a pesquisar uma maneira de amenizar o perigo, e no mesmo ano da explosão descobriu que se o composto fosse adsorvido em algum material poroso teria estabilidade. Assim, testou vários aditivos até chegar a uma mistura com uma argila chamada “kieselguhr”, e vendo a estabilidade após os experimentos, ele chamou a mistura de Dynamite. Após a descoberta desta mistura Nobel tornou-se um dos homens mais ricos, por que muitas empresas produtoras de nitroglicerina fecharam suas portas, em virtude de muitas tragédias e explosões, além do que foram criadas leis, que proibiam a sua fabricação em vários países.
A dinamite esteve presente em vários fatos importantes entre eles a abertura do canal de Suez. Apesar da proposta de Nobel de usar o composto somente para a construção civil, veio o advento da 1ª Guerra Mundial e esta foi empregada eficazmente como arma letal.
Atualmente a dinamite é fabricada adicionando-se a nitroglicerina, aditivos como nitratos de amônio e sódio (explosivos) e celulose, além do carbonato de cálcio com o objetivo de diminuir a acidez evitando reações que possam detonar a bomba. Sua utilização hoje está concentrada principalmente na mineração, indústria petrolífera e na construção civil, e ainda por terroristas. Esse composto é também utilizado como fármaco vasodilatador para pacientes com doenças cardiovasculares.
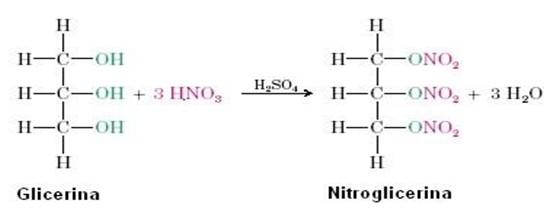
A nitroglicerina é obtida através da nitração da glicerina, catalizada por ácido sulfúrico, esse tipo de reação faz parte das mais importantes onde o ácido nítrico, fornece o NO2, que substitui os hidrogênios das hidroxilas presentes na molécula ligando-se ao oxigênio, devido a característica oxidante e desidratante do ácido sulfúrico que apenas participa da reação porém não é consumido. Obtenção da nitroglicerina ocorre segundo a reação:
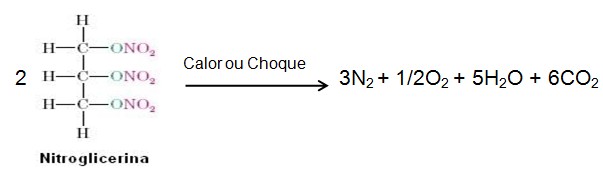
O efeito explosivo da nitroglicerina se deve a liberação dos gases N2, O2, e CO2, que são violentamente liberados no momento do choque ou no fornecimento de calor. Os gases apresentam este comportamento em razão de ocuparem um espaço superior ao ocupado pelos líquidos, e quando aquecidos ocupam ainda mais espaço o que provoca a explosão; essa reação é extremamente exotérmica, e ocorre da seguinte maneira:
Bibliografia:
ALLINGER, Norman L. et al. Química Orgânica. 2. ed. Rio de Janeiro : LTC, [1976].
SOLOMONS, T.W.G.; FRYHLE, C.B. Química Orgânica. Rio de Janeiro: LTC Editora. Vol 1, 7.ed., 2001
https://web.archive.org/web/20100821055128/http://www.ufsm.br:80/engcivil/Material_Didatico/TRP1002_Mat_para_infraentrutura_de_transp/notas_de_aula/Explosivos.pdf
Texto originalmente publicado em https://www.infoescola.com/compostos-quimicos/nitroglicerina/