A lei de partição ou distribuição, também chamada de lei da partição de Nernst em homenagem ao físico-químico alemão Walther Nernst que estudou o assunto, estabelece uma relação de equilíbrio entre um soluto dissolvido em duas fases imiscíveis.
Suponha que em um líquido A esteja dissolvida uma certa quantidade de soluto S, caso uma segunda fase B imiscível com A seja coloca em contato com essa solução ocorrerá um processo de extração, onde o soluto S será transferido lentamente para a fase B.
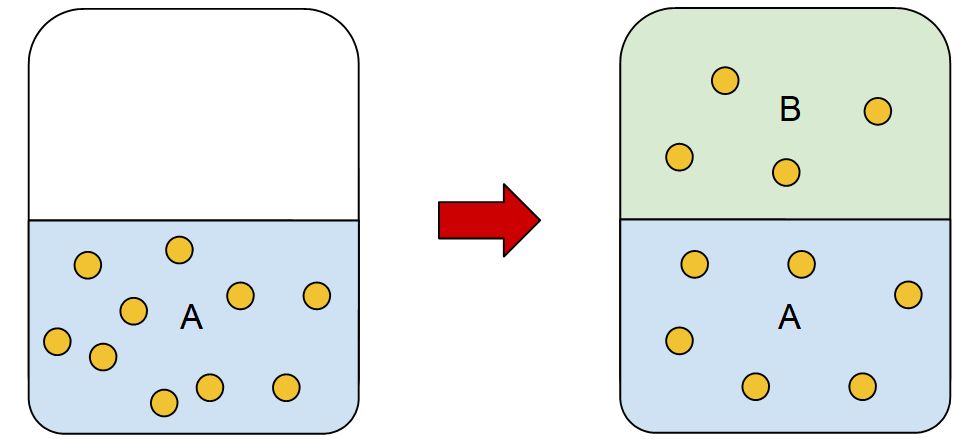
A transferência de matéria ocorre até um determinado ponto, onde os sistemas entram em equilíbrio. Observa-se que as concentrações na fase A e B podem ser relacionadas de acordo com a expressão matemática da lei de partição:
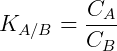
Onde C é a concentração do soluto e K é o coeficiente de distribuição ou partição. No exemplo acima quanto maior o coeficiente de partição maior a concentração do soluto em A.
O coeficiente de partição depende da natureza dos líquidos e da afinidade do soluto por eles, esse valor varia ainda de acordo com a temperatura, pressão e pH das soluções.
Existem basicamente duas formas de interpretar essa expressão. Do ponto de vista cinético entendemos que no equilíbrio a velocidade com que o soluto é transferido da fase A para fase B é a mesma do processo contrário. Do ponto de vista termodinâmico dizemos que no equilíbrio as duas fases tem o mesmo potencial químico.
Considerações sobre a natureza das substâncias envolvidas também são importantes. As fases A e B devem ser imiscíveis, então no geral esse tipo de sistema envolve um líquido polar e outro apolar. Nesse sentido soluto apolares, como hidrocarbonetos, vão preferir dissolver-se na fase apolar, enquanto solutos polares, como sais, se concentrarão na fase polar.
Um sistema de partição típico é o octanol/água. Esse sistema é muito estudado, tendo aplicações em biologia e farmacologia. O coeficiente de partição nesse caso é:
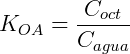
Considere que adicionamos 0,1 mol de n-butanol num sistema onde temos 200 mL de octanol e 400 mL de água. Assumindo que o coeficiente de distribuição do n-butanol é 7,4 podemos calcular a concentração em cada uma das fases. Expressando KOA em função do número de mols temos:
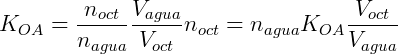
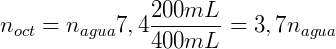
Sabemos também que a soma do número de mols de n-butanol em cada fase deve ser igual a número de mols total:
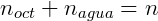
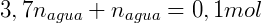
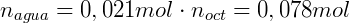
Por fim utilizamos o volume de cada fase para calcular a concentração:
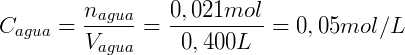
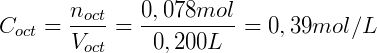
Utilizando a lei da partição de Nernst conseguimos então descrever esse sistema.
Texto originalmente publicado em https://www.infoescola.com/fisico-quimica/lei-da-particao-de-nernst/