O processo de difusão fracionada é utilizado como método de separação de isótopos por difusão através do uso de paredes porosas. Nesse processo, o isótopo mais pesado difunde mais lentamente. Conforme a diferença de massas entre os isótopos, a separação é assim efetuada em maior ou menor número de estágios. A Lei de Graham, que regulamenta e caracteriza o fenômeno, diz que “A velocidade de efusão dos gases é inversamente proporcional às raízes quadradas de seus pesos moleculares”1, de acordo com a equação abaixo, na qual V representa a velocidade do gás e M seu peso molecular.
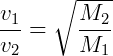
“Thomas Graham foi um químico britânico, que estudou a efusão gasosa e criou a lei que a explica”2. Esta lei química torna-se verdadeira quando os gases são submetidos à mesma pressão e à mesma temperatura. Dessa forma, quanto mais leve for a substância em relação à outra, maior será a facilidade de separação desta, pois a diferença percentual de suas massas tende a ser maior.
Neste sentido, os termos difusão e efusão merecem destaque, uma vez que não podem ser utilizados como sinônimos.
DIFUSÃO: Fenômeno pelo qual dois líquidos ou dois gases misturam-se espontaneamente devido à cinética de suas moléculas ou átomos.
EFUSÃO: Escapamento de um gás através de uma pequena abertura, orifício ou poro.
Laboratorialmente, pode-se confirmar a Lei de Graham através da reação química em fase gasosa entre os gases ácido clorídrico (HCl) e amônia (NH3), de acordo com os passos indicados abaixo:
1. Pegar um tubo fino, incolor e o mais longo possível.
2. Fechar suas duas extremidades com chumaços de algodão.
3. Ao mesmo tempo, gotejar HCl em uma das extremidades e hidróxido de amônio (NH4OH) na outra, ambos de concentração 1 molar, sendo que esta base irá liberar o NH3 gasoso. Como essas duas substâncias são voláteis, os vapores de HCl e NH3 irão se difundir pelo interior do tubo e reagir no ponto de contato, formando uma névoa branca de NH4Cl, conforme a equação abaixo:
HCl(g) + NH3(g) → NH4Cl(s)
4. Anotar as distâncias percorridas pelos gases.
5. Repetir o procedimento por mais duas vezes, trabalhando com valores médios.
6. Se julgar necessário, repetir o experimento uma segunda vez, dobrando as concentrações dos reagentes, ou uma terceira, trabalhando com reagentes concentrados.
Verificar-se-á então que essa névoa estará mais próxima da extremidade onde foi gotejado HCl (de maior peso molecular) do que da extremidade contendo NH3 (de menor peso molecular).
No experimento descrito, deve-se trabalhas com os equipamentos de proteção individuais (EPIs) adequados e sob sistema de exaustão química (capela), uma vez que os dois reagentes utilizados possuem elevada toxicidade.
Referências:
1. http://www2.fc.unesp.br/lvq/exp04.htm
2. http://www.colegioweb.com.br/quimica/difusao-e-efusao-gasosa.html
Texto originalmente publicado em https://www.infoescola.com/fisico-quimica/lei-de-graham/