A evaporação ou vaporização são fenômenos que estamos acostumados a observar no dia a dia, quando a roupa seca no varal ou mesmo quando sentimos cheiro de um perfume estamos observando uma mudança de fase onde as moléculas de água ou do perfume escapam da fase líquida para a fase gasosa. Em um ambiente aberto esse processo ocorre de forma contínua até que, por exemplo, nossas roupas sequem.
Num recipiente fechado contendo um líquido de uma determinada substância, também ocorre evaporação onde as moléculas de maior energia cinética conseguem escapar do líquido. Esse vapor que foi formado exerce pressão sobre o líquido, e quando as duas fases entram em equilíbrio termodinâmico essa pressão é chamada de pressão de vapor.
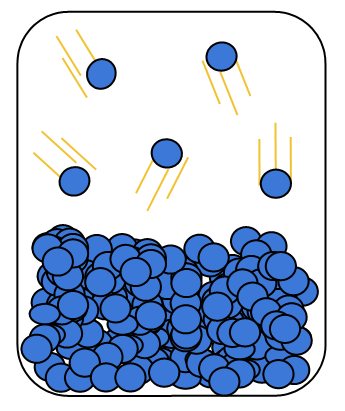
A pressão de vapor é uma medida da volatilidade de uma substância. Substâncias com alta pressão de vapor são mais voláteis, enquanto que substância com baixa pressão de vapor são substância pouco voláteis. A volatilidade por sua vez depende da natureza química da substância e está intimamente relacionada com as forças que mantêm as moléculas unidas, forças de Van der Waals. Substância que apresentam fortes interações intermoleculares, como ligações de hidrogênio terão pressão de vapor baixa e portanto baixa volatilidade. Por outro lado substâncias que interagem de forma fraca, por forças de dispersão de London, por exemplo, terão pressão de vapor maior e logo serão mais voláteis.
A pressão de vapor depende fortemente da temperatura do sistema, quanto maior a temperatura maior será a pressão de vapor do composto. Isso é coerente com nossa noção de mudança de fase, uma vez que quanto maior a temperatura, mais as substâncias tendem a fase gasosa. Para diversos propósitos é interessante saber prever a pressão de vapor de substâncias a qualquer temperatura. Nesse sentido algumas expressões foram elaboradas, uma delas a equação de Clausius-Clapeyron que foi derivada a partir de argumentos termodinâmicos:
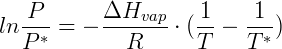
Onde 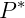 é a pressão de vapor na temperatura
é a pressão de vapor na temperatura 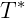 e
e 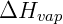 é a entalpia de vaporização da substância. Apesar de útil essa equação parte de um modelo ideal que nem sempre é válido. Desta forma uma segunda expressão foi derivada a partir desta, ajustando-se parâmetros experimentais para obtenção da chamada equação de Antoine:
é a entalpia de vaporização da substância. Apesar de útil essa equação parte de um modelo ideal que nem sempre é válido. Desta forma uma segunda expressão foi derivada a partir desta, ajustando-se parâmetros experimentais para obtenção da chamada equação de Antoine:
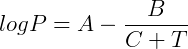
Onde T é a temperatura e A, B e C são constantes específicas para cada substância.
A uma determinada temperatura a pressão de vapor do líquido será igual à pressão exterior, quando isso ocorre observa-se que o líquido entra em ebulição. A temperatura de ebulição de uma substância é então a temperatura em que sua pressão de vapor se iguala à pressão externa. Utilizando as equações anteriores com a pressão desejada e tendo os parâmetros necessários é possível determinar a temperatura de ebulição de qualquer substância a uma dada pressão.
Referência:
ATKINS, P. W.; PAULA, Julio de. Físico-química. 8. ed. Rio de Janeiro: LTC, 2008. 2 v. ISBN 9788521616009 (v.1).
Texto originalmente publicado em https://www.infoescola.com/fisico-quimica/pressao-de-vapor/