Juntamente com as aminas e as nitrilas, as amidas compreendem uma das três mais importantes funções da química orgânica envolvendo o elemento nitrogênio. Teoricamente, pode-se definir uma amida como sendo todo composto orgânico derivado da molécula de amônia (NH3), pela substituição de um de seus átomos de hidrogênio por um grupamento acil.
As amidas possuem fórmula geral R1– COO – NR2, onde R1 e R2 podem ser iguais ou distintos, conferindo simetria à amida (no primeiro caso) e assimetria (no segundo). Sua nomenclatura consiste em se nomear R1 (de acordo com o número de carbonos existente) e seguir-se pelo sufixo amida. No caso de R2 apresentar carbono, será nomeado precedido da letra N maiúscula, para indicar-se que está diretamente ligado ao nitrogênio da molécula.
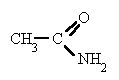
Por exemplo, o composto abaixo recebe o nome de etanoamida, em vista de possuir dois átomos de carbono no R1.
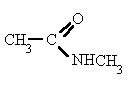
Já o composto abaixo deve ser nomeado como N-metil-etanoamida, pois, além do R1, apresenta um átomo de carbono como R2.
De acordo com sua utilização, as amidas correspondem como uma das mais importantes funções da química orgânica. “A amida mais conhecida é a diamida, a uréia. É um sólido branco e cristalino e solúvel em água. É um dos produtos finais do metabolismo dos animais eliminado pela urina. Na indústria química é muito utilizado como fertilizante químico para fornecer nitrogênio ao solo, na alimentação do gado, como matéria-prima para produzir plásticos e produtos farmacêuticos, medicamentos sedativos e como estabilizador de explosivos” 1.
Laboratorialmente percebe-se que as amidas possuem caráter anfótero, isto é, reagem quimicamente tanto com ácidos como com bases, de acordo com os procedimentos descritos a seguir.
Reações com ácidos
- Coloca-se em um copo de béquer de 100mL duas pontas de espátula de etanamida (uréia) e 2mL de ácido sulfúrico (H2SO4) 0,25M. Sobre o copo coloca-se um vidro de relógio, ao qual prende-se uma tira de papel de tornassol azul, úmido. Aquece-se suavemente. Observa-se então que o papel de tornassol azul fica vermelho, caracterizando ocorrência de reação.
Reações com bases
- Coloca-se em um copo de béquer de 100mL duas pontas de espátula de etanamida (uréia) e 2mL de hidróxido de sódio (NaOH) 0,5M. Sobre o copo coloca-se um vidro de relógio com uma tira de papel de tornassol vermelho. Aquece-se e então observa-se que o papel de tornassol vermelho passa para azul, caracterizando ocorrência de reação.
- Colocou-se duas pontas de espátula de uréia em um tubo de ensaio e adiciona-se 3mL de água destilada. Acrescenta-se 3mL de solução de hidróxido de sódio (NaOH) 0,5M. Aquece-se. Aproxima-se da boca do tubo uma tira de papel tornassol vermelho umedecida. Observa-se que a fita de tornassol vermelha passa para azul, caracterizando nova reação.
Referências:
http://www.soq.com.br/conteudos/em/funcoesorganicas/p23.php
Texto originalmente publicado em https://www.infoescola.com/quimica/carater-anfotero-das-amidas/