O tema solução, geralmente integrante dos currículos do 2° ano do Ensino Médio brasileiros, aborda um capítulo de fundamental importância para o estudante, uma vez que abrange aspectos teóricos, laboratoriais e cálculos químicos. Dessa forma, apresenta-se nesse texto uma introdução teórica ao assunto, que visa facilitar sua apresentação aos alunos, tanto na escola como no laboratório de química.
Conteúdo deste artigo
Definição
Soluções são misturas homogêneas que apresentam uma única fase. Por exemplo, determinada massa de cloreto de sódio, ao ser completamente diluída em certo volume de água, forma uma solução.
Componentes
Uma solução verdadeira é constituída, no mínimo, por dois componentes:
- SOLUTO: é aquele que está presente em menor proporção, em massa.
- SOLVENTE: é aquele que está presente em maior proporção, em massa.
Sendo que a mistura homogênea entre soluto e solvente recebe o nome de solução. Nem toda solução apresentará a água como solvente, conforme pode se observar abaixo:
- Ao misturarmos 1g de cloreto de sódio (NaCl) em 1 litro de H2O, teremos uma solução, na qual o NaCl é o soluto e a água é o solvente
- O álcool comercial comprado em supermercados trata-se de uma mistura homogênea entre álcool e água, geralmente constituída de 92% de álcool e 8% de água. Nesse caso, o álcool é o solvente e a água é o soluto.
Classificações
Uma solução pode ser classificada a partir de várias de suas propriedades, sendo de maior importância as classificações abaixo:
- Quanto ao estado físico: Poderemos ter uma solução em qualquer estado físico da matéria sendo assim:
- Soluções Sólidas: recebem o nome de ligas, e geralmente tratam-se de uma mistura homogênea entre metais.Por exemplo, o ouro 18 quilates é uma mistura constituída por ouro, cobre e prata. Já o bronze é uma mistura dos metais zinco e estanho.
- Soluções Líquidas: podem ser de três naturezas distintas:
- Sólidos dissolvidos em líquidos: por exemplo, água do mar é uma solução que apresenta vários solutos, entre eles, cloreto de sódio, cloreto de magnésio (MgCl2) e bicarbonatos (HCO3-).
- Líquidos dissolvidos em líquidos: por exemplo, temos o combustível denominado gasolina, que é uma mistura de hidrocarbonetos derivados do petróleo, e álcool, em uma proporção aproximada de 80% para 20%.
- Gases dissolvidos em líquidos: por exemplo, em um aquário deve-se diluir gás oxigênio (O2) na água, sendo este gás o responsável pela respiração dos peixes. Sendo assim, caso o aquário não permaneça aberto, é necessário injetar-se regularmente este gás por meio de um cilindro.
- Soluções Gasosas: são aquelas constituídas apenas por gases, sendo que toda mistura entre gases apresenta uma única fase, sendo, portanto, uma solução. Por exemplo, o ar atmosférico é uma mistura constituída por 78% de gás nitrogênio (N2), 21% gás oxigênio e 1% de outros gases.
- Quanto à natureza das partículas dispersas: De acordo com a natureza do soluto, podemos ter dois tipos de soluções:
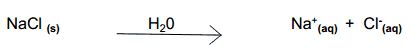
- Soluções Iônicas: são aquelas que apresentam íons dissolvidos. São chamadas também de soluções eletrolíticas, pois conduzem corrente elétricas. Por exemplo, ao diluirmos 1g de sal de cozinha (NaCl) em água, teremos uma solução que apresenta os íons Na+ e Cl- dissolvidos, de acordo com o esquema abaixo:

- Soluções moleculares: são aquelas formadas por moléculas dissolvidas. São também chamadas de não eletrolíticas, pois não conduzem corrente elétrica. Por exemplo, ao repetirmos o procedimento anterior, mas desta vez utilizando o açúcar (C12H22O11) ao invés do sal, perceberemos (de acordo com a equação abaixo) que não há separação do soluto, portanto, trata-se de uma solução constituída por moléculas dissolvidas, molecular.

- Soluções Iônicas: são aquelas que apresentam íons dissolvidos. São chamadas também de soluções eletrolíticas, pois conduzem corrente elétricas. Por exemplo, ao diluirmos 1g de sal de cozinha (NaCl) em água, teremos uma solução que apresenta os íons Na+ e Cl- dissolvidos, de acordo com o esquema abaixo:
- Quanto à proporção entre soluto e solvente: De acordo com as quantidades em massa de soluto e solvente presente na solução, poderemos ter quatro possibilidades de classificação. Para compreendê-las, precisamos conhecer o conceito de coeficiente de solubilidade (CS). O CS representa a quantidade máxima de determinado soluto que poderemos dissolver em 100 g de água,em temperatura ambiente. Assim, afirmar que CS NaCl = 37g/100g de H2O, significa que a cada 100g de água poderemos dissolver em temperatura ambiente, o máximo de 37g de NaCl. Agora, poderemos compreender as classificações mais simples possíveis para uma solução quanto à proporção entre soluto e solvente.
- Soluções diluídas: são aquelas que possuem uma pequena quantidade de soluto em relação à quantidade de solvente. Por exemplo, uma solução formada por 1g de NaCl para 100g de água.
- Soluções concentradas: são aquelas que possuem grande quantidade de soluto em relação à de solvente. Por exemplo, uma solução formada por 30g de NaCl em 100g de água;
- Soluções saturadas: são aquelas formadas pelo máximo de soluto permitido, em relação ao seu coeficiente de solubilidade. Por exemplo, uma solução constituída por 37g de NaCl em 100g H2O.
Referências:
PERUZZO, Francisco Miragaia (Tito); CANTO, Eduardo Leite; Química na Abordagem do Cotidiano, Ed. Moderna, vol.1, São Paulo/SP- 1998.
MAHAN, Bruce M.; MYERS, Rollie J.; Química: um curso universitário, Ed. Edgard Blucher LTDA, São Paulo/SP – 2002.
Texto originalmente publicado em https://www.infoescola.com/quimica/classificacao-de-solucoes/