Compostos de coordenação são moléculas formadas por um ou vários ácidos de Lewis, que fazem ligação com uma ou várias bases de Lewis. Esses compostos são muitas vezes também denominados de complexos. Antes de falarmos mais sobre esses compostos, vale relembrar rapidamente o que são ácidos e bases de Lewis. Ácidos de Lewis são espécies químicas que ao formarem ligação funcionam como receptoras de par de elétrons. Já as bases de Lewis, atuam como doadoras de elétrons durante a ligação.
A primeira teoria sobre esses compostos foi publicada em 1893, por Alfred Werner, que a partir de então forneceu as bases para toda a química de coordenação moderna. Nos compostos de coordenação temos um átomo central de metal ou íon metálico atuando como ácido de Lewis, rodeado por íons ou moléculas, chamados de ligantes, que são bases de Lewis. Os compostos de coordenação podem ser eletricamente neutro, como é o caso do Ni(CO)4, ou apresentar carga como por exemplo, [Co(NH3)6)]3+. Os ligantes podem ser neutros (moléculas) ou íons e a ligação que se estabelece entre eles e o átomo central é chamada de coordenada ou ligação covalente. Alguns exemplos de complexos formados por ligante neutro, são os com amônia (NH3) como o [Co(NH3)6]3+ ou com monóxido de carbono (CO), como o Ni(CO)4. Outros tipos de ligantes neutros são monóxido de nitrogênio (NO), nitrogênio (N2) e hidrogênio (H2). Entre os compostos formados por ligantes iônicos temos uma divisão entre aniônicos, entre eles o F-, Cl-, Br -, I- e CN-, e o oxiânions, SO42-, H3CCOO-, C2O42- e CO32- . Os ligantes tem pelo menos 1 par de elétrons livres que permite a ele se coordenar ao metal para formar os complexos. Com base nisso eles podem ser divididos classificados em monodentados, bidentados, tri, e assim por diante. Um dos ligantes mais famosos é o EDTA, que é um hexadentado, ou seja, ele se coordenada ao metal através de seis ligações. A figura abaixo ilustra bem isso, onde uma única molécula de EDTA se liga através de seis pontos diferentes ao metal.
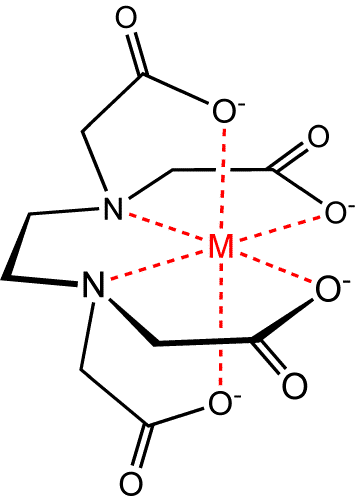
Figura 1: Pontos de ligação da molécula de EDTA a um metal.
O número de pontos aos quais o ligante se liga ao metal é chamado de numero de coordenação, no caso de um complexo formado entre Ca e EDTA, cuja fórmula é CaEDTA, por exemplo, o número de coordenação é 6. No caso de uma molécula formada entre ferro e o ligante CN-, cuja fórmula é [Fe(CN)6]4-, o número de coordenação também é 6, porém nesse caso temos 6 ligantes, que são monodentado, então cada um se liga através de um ponto ao metal central. É preciso ter atenção ao olhar a fórmula de complexo e não julgar o número de coordenação de acordo com o número de ligantes, porém é sempre importante ter em mente através de quantos pontos o ligante se coordena ao metal. Vejamos por exemplo o caso do complexo formado entre Ca e o íon oxalato (C2O4)2-, cuja formula do complexo fica é CaC2O4, embora tenha apenas um ligante, o número de coordenação é 2, já que este íon se liga através de 2 pontos ao metal.
Referencias bibliográficas:
Tito e Canto. Química na Abordagem do Cotidiano. Volume único, parte A – Química Geral e Inorgânica. Editora Saraiva 2005.
Atkins, P. W.; Jones, Loretta . Princípios de química: questionando a vida moderna e o meio ambiente, volume único. 3. ed. Porto Alegre: Bookman, 2006.
Química de Coordenação: Um Sonho Audacioso de Alfred Werner Santos, L. M.;* Sarto, L. E.; Bozza, G. F.; de Almeida, E. T. Rev. Virtual Quim., 2014, 6 (5), 1260-1281. Data de publicação na Web: 6 de julho de 2014.
Texto originalmente publicado em https://www.infoescola.com/quimica/compostos-de-coordenacao/