Um ácido, de acordo com uma de suas definições, trata-se de uma espécie química capaz de ionizar-se, liberando íons de hidrogênio (H+) em meio aquoso. Sua identificação teórica pode se dar com relação à presença do elemento hidrogênio em sua molécula, ou experimentalmente por sua propriedade de liberação desse hidrogênio no estado gasoso quando em reação química com metal mais reativo do que o hidrogênio.
Abaixo são mostrados dois exemplos de ácidos de elevada importância, tanto para a indústria como no laboratório de pesquisa, o primeiro um hidrácido (não apresenta oxigênio em sua molécula) e o segundo um oxiácido (apresenta o oxigênio).
HCl: ácido clorídrico
H2SO4: ácido sulfúrico
Quando um ácido se ioniza em água, passa a ocorrer um processo de equilíbrio, representado por:
HA + H2O ↔ A- + H3O+
Ou ainda, de modo simplificado:
HA ↔ A- + H+
O grau de ionização de um ácido é denominado de constante de acidez, e representado por Ka. O nome de constante de ionização também é empregado, e pode ser definido matematicamente conforme mostrado abaixo:
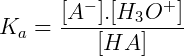
As espécies representadas entre conchetes representam suas concentrações molares. Dessa forma, o cálculo da constante de acidez considera o quociente entre o produto da concentração molar de sua base conjugada e de seu número de íons de hidrogênio, pelo de suas partículas não ionizadas. Deste modo, seu valor de Ka é diretamente proporcional à concentração iônica, o que indica que quanto maior for o valor de Ka para um ácido, maior será sua ionização e maior será a força desse ácido.
A Tabela 1 mostra o valor de constante de acidez para alguns ácidos, na temperatura de 25°C (a temperatura interfere significativamente no Ka de um ácido).
|
ÁCIDOS |
Ka |
FORÇA ÁCIDA |
|
HCl |
10+7 |
Muito Forte |
|
H2SO4 |
10+3 |
Muito Forte |
|
H2SO3 |
1,5.10-2 |
Forte |
|
H3PO4 |
7,6.10-3 |
Fraco |
|
HNO2 |
4,3.10-4 |
Fraco |
|
HF |
3,5.10-4 |
Fraco |
|
CH3COOH |
1,8.10-5 |
Fraco |
|
H2CO3 |
4,3.10-7 |
Fraco |
|
H2S |
1,3.10-7 |
Fraco |
|
HCN |
4,9.10-10 |
Muito Fraco |
Tabela 1. Constante de acidez de alguns ácidos 1.
No topo da tabela estão os ácidos mencionados no início deste texto. Tanto o ácido clorídrico quanto o ácido sulfúrico apresentam elevado Ka, tratando-se de ácidos muito fortes. Já o ácido cianídrico, em contraponto, apresenta um baixo Ka, tratando-se de um ácido muito fraco. Dessa forma, podemos concluir que uma solução de ácido clorídrico ou de ácido sulfúrico apresenta uma grande parte de íons em solução, já uma solução a partir do ácido cianídrico apresenta grande parte de moléculas dissolvidas.
Experimentalmente pode-se averiguar esse comportamento ao se fazer tais soluções serem atravessadas por uma corrente elétrica, compondo um circuito capaz de acender uma lâmpada, por exemplo. Observa-se então que em todas as soluções há passagem de corrente elétrica, mas a lâmpada está mais intensa na medida em que o ácido é mais forte (apresenta um maior número de partículas iônicas em solução, responsáveis pela transmissão de corrente elétrica).
Referências:
1. http://www.soq.com.br/conteudos/em/equilibrioquimico/p4.php
ATKINS, Peter; JONES, Loreta; Princípios de Química: questionando a vida moderna e o meio ambiente, Porto Alegre: Bookman, 2001.
Texto originalmente publicado em https://www.infoescola.com/quimica/constante-de-acidez/