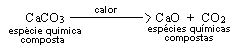A Química é a ciência que estuda a matéria. Matéria é tudo aquilo que possui massa e ocupa lugar no espaço. Um corpo é uma porção limitada de matéria. Um objeto é quando esta limitação é transformada em um utensílio em benefício próprio do homem. Assim, a madeira é matéria, um tronco de árvore é considerado um corpo, e uma cadeira feita de madeira é um objeto.
Conforme sua constituição, a matéria poderá representar uma substância pura ou uma mistura. As substâncias puras, também chamadas de espécies químicas, podem ser de dois tipos: simples e compostas. Assim:
- Substância pura simples: é toda substância formada por átomos de um único elemento químico. Por exemplo: ferro (Fe), formado unicamente por átomos de ferro. Hidrogênio (H2), formado unicamente por átomos do elemento hidrogênio. Ozônio (O3), formado unicamente por átomos do elemento oxigênio.
- Substância pura composta: é toda substância formada por átomos de dois ou mais elementos químicos. Por exemplo: água (H2O), formada por átomos de dois elementos: hidrogênio e oxigênio. Gás carbônico (CO2), formado por átomos de dois elementos: carbono e oxigênio. Carbonato de cálcio (CaCO3), formado por átomos de três elementos: cálcio, carbono e oxigênio.
Verifica-se experimentalmente que as substâncias puras compostas (espécies químicas compostas) podem se desdobrar, ou seja, sofrer decaimento ou dissociação, por meio de processos laboratoriais, e resultar em produtos com duas ou mais substâncias diferentes. Entretanto, as substâncias puras simples não podem ser desdobradas, por processos laboratoriais, em duas ou mais substâncias diferentes.
Três substâncias puras compostas, no caso a água (por meio de uma corrente elétrica), o carbonato de cálcio e o óxido de mercúrio (através do aquecimento) são desdobradas em substâncias diferentes das iniciais, conforme mostrado abaixo.
a) A água é uma substância pura composta que, por ação da corrente elétrica, se decompõe e produz as substâncias puras simples hidrogênio (H2) e oxigênio (O2), conforme processo equacionado a seguir:
b) O carbonato de cálcio é uma substância pura composta que, por ação do calor, se decompõe e produz as substâncias puras compostas óxido de cálcio (CaO) e gás carbônico (CO2), conforme processo equacionado a seguir:
c) O óxido de mercúrio é uma substância pura composta que, por ação do calor, se decompõe e produz as substâncias puras simples mercúrio (Hg) e oxigênio (O2), conforme processo equacionado a seguir:
Esse critério pode ser empregado para a classificação de uma substância pura em simples ou composta: sua possibilidade de fragmentação.
Referências:
FELTRE, Ricardo; Fundamentos da Química, vol. Único, Ed. Moderna, São Paulo/SP – 1990.
Texto originalmente publicado em https://www.infoescola.com/quimica/desdobramento-de-substancias-compostas-em-substancias-simples/