O ácido ascórbico, popularmente conhecido como Vitamina C, é um importante suprimento orgânico, necessário diariamente, e está associado a diversas funções metabólicas essenciais. Citrinos, groselhas pretas, pimentão doce, salsa, couve-flor, batatas, batata-doce, bróculos, couves de bruxelas, morangos, goiabas, manga. Dependendo da estação, um copo de tamanho médio de suco de laranja fresco rende cerca de 15 a 30mg de vitamina C.
O ácido ascórbico apresenta indicações importantes, como profilaxia e tratamento da carência de vitamina C devido a suprimento deficiente, ou por aumento das necessidades, como ocorre nas gripes e resfriados e nos casos de ferimentos intensos, queimaduras profundas, fraturas e infecções crônicas. Na profilaxia e tratamento do escorbuto, da metemoglobinemia idiopática, da cárie dentária, da desnutrição, das infecções em geral e como acidificante da urina. E apresenta também precauções a serem consideradas, como a varfarina sódica - pode ocorrer aumento do tempo de protrombina. Deferoxamina - tem atividade diminuída e potenciados os efeitos tóxicos do ferro. Vitamina B12 - tem atividade reduzida. O ácido ascórbico pode interferir nos resultados para determinação de glicemia, glicosúria no sangue e urina, e dos níveis séricos das transaminases de creatinina e bilirrubina. Pode condicionar resultados falso-negativos em pesquisa de sangue oculto nas fezes.
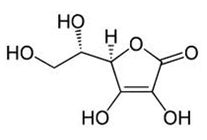
A molécula deste ácido, mostrada abaixo, mostra sue poder de oxidação, o que o faz ser eficiente no combate aos radicais livres. Nela podem ser vistos as funções orgânicas alcoóis, enóis e éster.
A experimentação descrita abaixo visa a determinação da massa deste ácido presente em determinados frutos cítricos, e necessita dos reagentes hidróxido de potássio (KI), à 5%, ácido sulfúrico (H2SO4) em solução 1 molar, iodato de potássio (KIO3), em solução 0,01 molar e goma de amido como indicador.
● PROCEDIMENTO EXPERIMENTAL:
1. Pipetar para erlenmeyer 10,0 mL de suco de fruta filtrado.
2. Juntar: 2,0 mL de solução de iodeto de potássio a 5 %;
4,0 mL de solução1 Mde ácido sulfúrico;
2,0 mL de solução de goma de amido.
3. Carregar uma bureta com solução dosadora, iodato de potássio0,01 M.
4. Gotejar a solução dosadora até o aparecimento da coloração azul, o que indica o ponto final da titulação.
O ácido ascórbico (vitamina C), pela ação oxidante do iodo, passa a dehidroascórbico. Quando todo o ácido ascórbico tiver reagido, o excesso de iodo (formado pela adição de mais uma gota de iodato de potássio) será indicado pelo amido, que adquire coloração azul na presença de iodo livre. As reações que ocorrem podem ser expressas pelas equações:
5 KI + 3 H2SO4 + KIO3 → 3 K2SO4 + 3 H2O + 3 I2
I2 + C6H8O6 (ác. Ascórbico) → C6H6O6 (ác. Deidroascórbico) + 2 HI
5. Repetir as operações indicadas nos itens1 a 4 com mais uma alíquota de suco.
6. Fazer a média das leituras feitas nas buretas e dos volumes de solução dosadora gastos na titulação de cada líquido.
Referências:
http://www.bulas.med.br/bula/3880/acido+ascorbico.htm
PERUZZO, Francisco Miragaia (Tito); CANTO, Eduardo Leite; Química na Abordagem do Cotidiano, Ed. Moderna, vol.1, São Paulo/SP- 1998
Texto originalmente publicado em https://www.infoescola.com/quimica/dosagem-de-acido-ascorbico-em-frutos-citricos/