Algumas espécies químicas não são representadas por apenas uma estrutura de Lewis simplesmente por aquela não ser a real. É dito que, se mais de um arranjo for necessário para descrever a real estrutura de uma espécie, tem-se o efeito mesomérico ou ressonância.
Apesar de, à primeira vista, o conceito de ressonância parecer não muito claro, a explicação é relativamente simples: quando a estrutura de Lewis é utilizada para representar algum íon composto (de mais de um elemento constituinte), molécula ou qualquer outra espécie, sempre levamos em consideração as ligações que cada parte realiza. O caso é que em algumas estruturas podemos perceber mais de uma possibilidade para essas ligações: imagine que uma molécula AB2, fictícia, possui 3 ligações, uma dupla entre B e A e uma simples entre A e B (B=A-B). Nada pode-se garantir que a estrutura real seja essa ou uma simples entre B e A e uma dupla entre A e B (B-A=B).
Assim, nenhuma das duas estruturas isoladas é a correta para a molécula citada, pois ambas são possíveis.
Representando o Híbrido de Ressonância
Alguns estudantes, até mesmo pela literatura consultada, imaginam que a real forma da molécula AB2 estaria sempre oscilando entre B=A-B e B-A=B. Porém, o que pode-se observar experimentalmente em estruturas ressonantes é que o comprimento de ligação está compreendida entre uma ligação simples e uma dupla. Ou seja, não é sensato pensar num equilíbrio dinâmico entre as duas formas porque na realidade isso não procede.
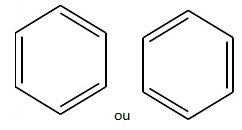
De fato, na molécula de benzeno (onde 6 átomos de carbono reproduzem uma estrutura em forma de anel), as ligações simples e duplas não oscilam entre si. Simplesmente, as ligações entre átomos de carbonos desse anel estão compreendidas entre uma simples e uma dupla.
Assim, é completamente equivocado representar a estrutura do benzeno como:
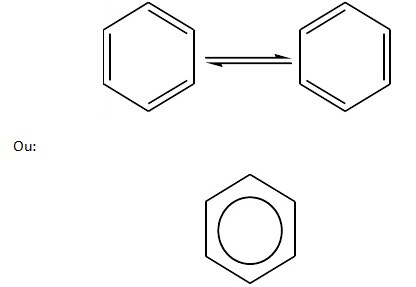
Mas, como:
Para o anel de benzeno, o círculo inscrito significa que os elétrons das ligações estão deslocalizados: a nuvem eletrônica é uniformemente distribuída pela molécula, conferindo, então, boa estabilidade.
Caso a molécula em questão não for semelhante ao benzeno, basta representar as estruturas possíveis com um híbrido de ressonância, com uma seta dupla:
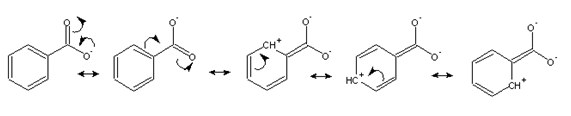
O ânion benzoato acima pode ser representado por 5 estruturas de Lewis diferentes: a real molécula é dita como um híbrido de ressonância destas.
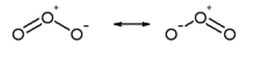
A molécula de ozônio também apresenta estruturas ressonantes, onde as cargas formais (calculadas pelo número de pares compartilhados e número de pares isolados após ligação subtraídos do número de pares no átomo fundamental) de dois átomos de oxigênio apresentam valores 0 e -1, e -1 e 0.
Bibliografia:
ATKINS, Peter. LORETTA, Jones. Princípios de química: questionando a vida moderna e o meio ambiente; tradução Ricardo Bicca de Alencastro. – 3ª Ed. – Porto Alegre: Bookman, 2006. 968 páginas.
http://www2.ufp.pt/~pedros/qo2000/resonancia.htm (acesso em 03/05/2011)
Texto originalmente publicado em https://www.infoescola.com/quimica/efeito-mesomerico/