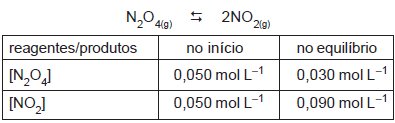
O equilíbrio químico é um fenômeno que ocorre em reações reversíveis. Uma reação reversível é aquela que pode ocorrer em qualquer sentido reacional. Independentemente do tempo de reação quando o equilíbrio químico de uma reação é atingido a conversão de produtos em reagentes nunca será completa. Podemos afirmar que o equilíbrio químico foi atingido quando as concentrações de todas as substâncias participantes permanecem constantes e quando a velocidade da reação direta e da reação inversa são iguais. Chamamos a este de equilíbrio dinâmico devido ao fato de as reações estarem ocorrendo continuamente.
Para calcularmos a constante de equilíbrio de uma reação química precisamos ter a reação química escrita de forma a aplicá-la a seguinte fórmula:
Reação: aA + bB ↔ cC + dD
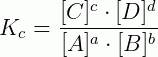
Para a reação do gás hidrogênio com Iodo formando o ácido iodídrico temos a seguinte constante conforme descrita abaixo:
H2 + I2 ↔ 2 HI
Kc = [HI]2 / ([H2] x [I2])
Quando sabemos o valor dessas concentrações podemos substituir na fórmula e obter o valor da constante. Abaixo podemos analisar o gráfico de uma reação que atingiu o estado de Equilíbrio:
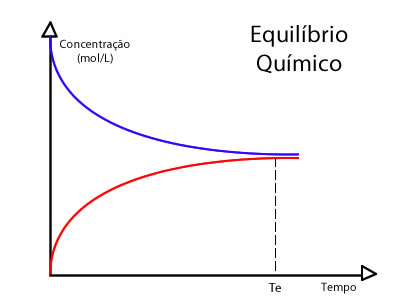
A partir deste gráfico podemos perceber que o equilíbrio químico se estabelece através de uma relação entre a concentração e o tempo. Até o Te temos a concentração dos reagentes reduzindo e a concentração dos produtos aumentando de forma que a partir do ponto Te o equilíbrio químico é atingido e então as concentrações passam a ser representadas por uma linha reta, ou seja, constantes.
Princípio de Le Chatelier
Este princípio afirma que quando um sistema em equilíbrio é sujeito à algum efeito, como por exemplo mudança na temperatura o equilíbrio desloca para um dos lados a fim de minimizar esse efeito.
Por exemplo, quando há aumento da concentração dos reagentes o equilíbrio desloca para o lado dos produtos, porém quando o inverso ocorre temos o equilíbrio deslocado para os reagentes. Quando há um aumento da temperatura o equilíbrio é deslocado para favorecer uma reação endotérmica e quando a temperatura é reduzida o equilíbrio se desloca a favor de uma reação exotérmica. No caso da variação na pressão, quando a mesma aumenta o equilíbrio desloca para o lado que contém menor número de moléculas e caso ela diminua o equilíbrio desloca para o lado de maior número de moléculas formadas. Já no caso do uso de um catalisador ou inibidor não há mudanças no equilíbrio.
Um exemplo de equilíbrio químico aplicado ao cotidiano é o de uma garrafa de refrigerante. Em uma garrafa de refrigerante há a decomposição/formação do ácido carbônico (H2CO3), que se decompõe em água e dióxido de carbono. Esta reação está em equilíbrio, pois a medida em que ocorre a decomposição, também ocorre a formação de ácido carbônico. Quando a garrafa é aberta, a pressão interna na garrafa diminui de forma que a diminuição da pressão favorece a decomposição do ácido carbônico, fazendo que a garrafa libere o gás.
Leia mais:
Referências:
Revise Wise, Chemistry, Jim McCarthy and Terence White
QUÍMICA: O HOMEM E A NATUREZA: FÍSICO-QUÍMICA, Geraldo Jose Covre
Texto originalmente publicado em https://www.infoescola.com/quimica/equilibrio-quimico/