Uma das mais importantes funções da Química Orgânica é a dos ácidos carboxílicos, que aparecem em muitas moléculas de natureza mista. Sua fórmula geral é R-COOH, e são identificados pela presença de um ou mais grupamento carboxílico. Os representantes mais importantes dos ácidos carboxílicos são: o ácido metanóico, o ácido etanóico, o ácido etanodióico (ác. oxálico), o ácido 2-hidróxipropano-tricarboxílico (ác. cítrico) e o ácido 2-hidróxibenzeno carboxílico (ác. salicílico).
O presente texto aborda algumas características experimentais dos ácidos carboxílicos, as quais podem ser executadas em laboratório básico de química.
a) Reação com metais: ácidos carboxílicos reagem com a maioria dos metais, liberando gás hidrogênio.
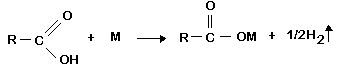
OBS: Onde M é um metal mais reativo do que o hidrogênio.
- Colocar em um tubo de ensaio 1mL de ácido etanóico 3M. Adicionar uma tira de magnésio, observar e anotar. Esperar até que todo metal seja consumido. Aquecer para evaporar o líquido. Explicar o que ocorreu.
b) Reação com bases: ácidos carboxílicos reagem com bases inorgânicas, em reações de neutralização.
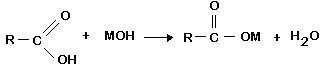
- Colocar em um tubo de ensaio 3mL de solução de hidróxido de sódio 2,5% e 2 gotas de fenolftaleína. Juntar, gota a gota, ácido etanóico diluído até o descoloramento da solução. Explicar a razão do descoloramento da solução.
c) Reação com carbonatos: ácidos carboxílicos reagem com carbonatos, produzindo éster e liberando gás carbônico.
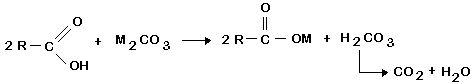
- Colocar em um tubo de ensaio 2mL de solução de carbonato de sódio. Adicionar 2mL de ácido etanóico 3M. Observar e anotar.
OBS: Também pode ser utilizado um carbonato do tipo MCO3 ou M2(CO3)3.
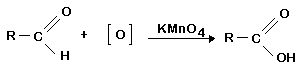
d) Oxidação: ácidos carboxílicos, no caso aquele que apresenta apenas um átomo de carbono, oxida-se com permanganato de potássio (KMnO4).
Os ácidos carboxílicos são resistentes à oxidação, com exceção do ácido metanóico.
- Colocar em dois tubos de ensaio 1mL de solução de KMnO4 e, respectivamente, 5mL de ácido metanóico e 5mL de ácido etanóico. Agitar e observar.
e) Obtenção: laboratorialmente pode-se obter ácidos carboxílicos, por meio de oxidação, ou ainda por extração de frutos cítricos.
1. Os ácidos carboxílicos podem ser obtidos por oxidação dos aldeídos.
- Em um tubo de ensaio colocar 5mL de etanal. Adicionar a este 1mL de solução KMnO4 0,05M. Agitar e observar o que ocorreu. Identificar o composto colocando duas tiras de magnésio.
2. Em um tubo de ensaio colocar 10mL de suco de limão e 10mL de água de cal. Haverá formação de precipitado. Filtrar. Colocar o precipitado em um copo de béquer de 100mL e adicionar 3mL de ácido sulfúrico 0,5M. Caso necessário, realizar nova filtração. Evaporar o filtrado em banho vapor. Observar a cristalização do ácido.
Referências:
FELTRE, Ricardo; Fundamentos da Química, vol. Único, Ed. Moderna, São Paulo/SP – 1990.
RUSSELL, John B.; Química Geral vol.1, São Paulo: Pearson Education do Brasil, Makron Books, 1994.
Texto originalmente publicado em https://www.infoescola.com/quimica/experimentacao-com-acidos-carboxilicos/