A reatividade química dos metais varia com sua eletropositividade, logo, quanto mais eletropositivo for o elemento, mais reativo será o metal. Os metais mais reativos são aqueles que possuem grande tendência a perder elétrons, logo, formam íons positivos com mais facilidade. Já a reatividade química dos não-metais varia com a eletronegatividade; logo, quanto mais eletronegativo for o elemento, mais reativo será o não-metal. Os não-metais mais reativos são aqueles que possuem grande tendência de receber elétrons, logo, formam íons negativos com mais facilidade.
Na parte A deste experimento, será observado algumas reações possíveis de oxi-redução que envolvem vários metais e íons metálicos. Analisando os resultados, poderá ser determinado as forças relativas dos metais como agentes redutores (tendência de perder elétrons, se oxidando) e dos íons metálicos como agentes oxidantes (tendência de ganhar elétrons, se reduzindo). A equação genérica abaixo traz esta idéia.
M(s) ↔ M2+(aq) + 2 elétrons
Na parte B será feito uma comparação semelhante do poder oxidante relativo de três elementos não metálicos do grupo 7A: cloro, bromo e iodo. Neste caso, será determinado qual molécula (Cl2, Br2 ou I2) é capaz de remover elétrons dos íons haletos (Cl-, Br- e I-) e assim dispor em ordem decrescente de facilidade de oxidação, as semi-reações entre íons haleto o elemento halogênio. A equação genérica abaixo traz esta idéia.
2X-(aq) → X2(s,l,g) + 2 elétrons
PARTE A:
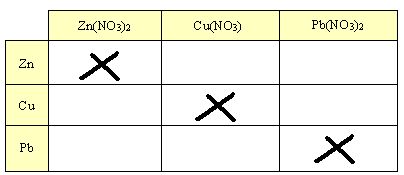
1. Obtenha pedaços ou fitas pequenas e limpas dos metais zinco (Zn), cobre (Cu) e chumbo (Pb). Tenha, também, as seguintes soluções: nitrato de zinco (Zn(NO3)2) de concentração0,1M, nitrato de cobre, Cu(NO3) 0,1M, e nitrato de chumbo, Pb(NO3)2 0,1M.
2. Observe possíveis reações de cada um dos metais em cada uma das soluções. Para cada combinação, conforme modelo abaixo, use 3,0 mL da solução em um tubo de ensaio e um pequeno pedaço de metal recentemente limpo.
3. Anote os casos em que ocorreram reações, de acordo com o modelo de tabela mostrado acima.
PARTE B:
1. Coloque em três tubos de ensaios distintos, 3,0 mL dos três halogênios em solução: no primeiro, cloro em água (Cl2(aq)); no segundo, bromo em água (Br2(aq)); no terceiro, iodo em água contendo um pouco de etanol (I2 é muito pouco solúvel em água).
2. Acrescente 1,0 mL de tetracloreto de carbono, CCl4, a cada tubo de ensaio. Tampe-os e agite-os durante 15 segundos aproximadamente. Observe a cor da fase tetracloreto de carbono que contém o halogênio dissolvido.
3. Anote as observações encontradas também sob a forma de uma tabela.
Referências:
PERUZZO, Francisco Miragaia (Tito); CANTO, Eduardo Leite; Química na Abordagem do Cotidiano, Ed. Moderna, vol.1, São Paulo/SP- 1998.
Texto originalmente publicado em https://www.infoescola.com/quimica/experimentacao-em-reatividade-quimica/