Conteúdo deste artigo
Introdução à Ciência dos Materiais
A técnica de fundição é uma das muitas utilizadas para a obtenção de materiais para utilização na indústria. A compreensão desta técnica parte do entendimento dos preceitos físicos que regem as reações que tornam possíveis a dissolução de diferentes elementos químicos num mesmo material, formando importantes alicerces para a indústria.
Neste estudo de fundição, estudaremos particularmente o caso dos aços e ferros fundidos, sendo necessário que se compreenda perfeitamente o que são estes materiais, os diagramas de fases, o mecanismo de nucleação e segregação.
O que é aço
A definição mais usual de aço é: “Aço é a liga ferro-carbono contendo geralmente 0,008% até 2,11% de carbono, além de certos elementos residuais resultantes dos processos de fabricação.”
O que é ferro fundido (FoFo)
A definição que usaremos neste estudo é a seguinte: “Ferro fundido é a liga ferro-carbono-silício, de teores de carbono geralmente acima de 2%, em quantidade superior à que é retida em solução sólida na austenita, de modo a resultar carbono parcialmente livre, na forma de veios ou lamelas de grafita”.
Limites de solubilidade
No desenvolvimento de um material, principalmente por fundição, os termos “soluto” e “solvente” fazem muito sentido. Para a maioria dos sistemas de ligas, onde dois ou mais elementos estão envolvidos, existirá um número máximo de átomos que conseguimos dissolver para formar uma solução sólida.
A dissolução de açúcar na água é um exemplo claro da existência do limite de solubilidade. A uma determinada temperatura, existirá um ponto em que a adição de mais açúcar resultará na formação de cristais não dissolvidos na água, quando teremos então um xarope de açúcar-água e cristais de açúcar. A solubilidade de açúcar em água pode ser alterada conforme a temperatura. A 100 ºC, por exemplo, é possível formar um xarope 80% açúcar a 20% água, enquanto que a 20 ºC essa dissolução não chega a 65%.
Fases
O conceito de fases é essencial para o estudo de fundição. Considere o exemplo anterior. O xarope açúcar-água é uma fase e os cristais de açúcar outra, com propriedades físicas e químicas distintas. Porém, para que se faça a distinção de uma fase para outra, somente a diferença entre as características química ou físicas são suficientes para a distinção de duas fases. Água e gelo são quimicamente iguais, por exemplo, mas a primeira é líquida e o segundo é sólido, formando assim duas fases. Um sistema pode ser monofásico - homogêneo - ou composto por duas ou mais fases, sendo assim chamado de “mistura” - ou sistema “heterogêneo”.
Microestrutura
Nas ligas metálicas, a microestrutura é caracterizada pela quantidade de fases presentes, pela maneira com que estão distribuídas/arranjadas e suas proporções. Ela determina o comportamento mecânico de um material, sendo por isso de fundamental importância compreender a formação dela durante o processo de solidificação.
Diagramas de fase
Todo esse assunto de limites de solubilidade, fases e microestrutura serve somente para que possamos entender os diagramas de fase. É por eles que descobriremos o resultado da fundição de algum material de determinada composição, por exemplo.
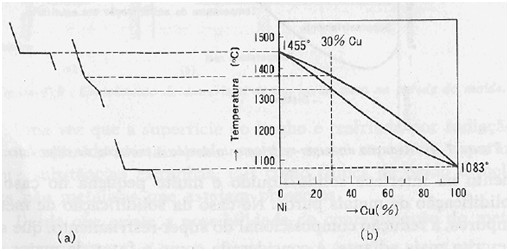
Um diagrama de fases é construído a partir de curvas de resfriamento, para diferentes composições da liga pretendida. A determinação das curvas de resfriamento é feita com a colocação de um termopar dentro do metal fundido, em vários intervalos de tempo. Uma curva de resfriamento pode ter 2 características, como mostra a figura 1.
Quando um metal puro é resfriado, nem sempre ele se comporta da maneira como acontece com o Níquel (onde a transição de fase acontece a temperatura constante). As condições de resfriamento, os calores específicos, a condutividade térmica entre fundido e molde e o calor latente de solidificação do metal podem fazer com que aconteça um super-resfriamento.
Nestes casos, para que o metal solidifique-se, é necessário que vá até uma temperatura inferior à de solidificação teórica para que comece finalmente a solidificar. Se houver metal suficiente no sistema, a temperatura de solificação é alcançada rapidamente após o super-resfriamento, devido a liberação de calor latente, como na figura 2 (a). Porém, se não houver metal suficiente, a curva de resfriamento ficará na forma da figura 2 (b). O caso da figura 2 (c) só acontece com materiais amorfos, como o vidro, que não solidificam uma estrutura cristalina.
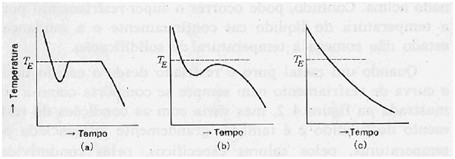
Figura 2 – (a) Super-resfriamento quando há metal suficiente (b) Super-resfriamento sem metal suficiente (c) Resfriamento de material sem fase cristalina.
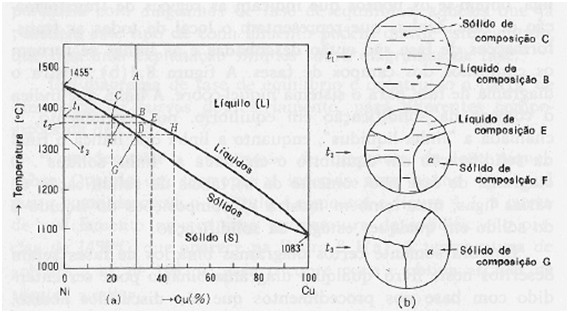
O diagrama de fases mais simples é o de Ní-Cu, sendo mais facilmente compreendido com o exemplo da Figura 3.
Em sistemas em equilíbrio, as transformações ocorreriam conforme a figura 3. No entanto, como para que o equilíbrio seja alcançado as velocidades de resfriamento devem ser baixíssimas, veremos que ocorrerá o fenômeno de segregação na solidificação, que ocasionará um gradiente de concentração nas partículas sólidas.
Texto originalmente publicado em https://www.infoescola.com/quimica/fundicao-conceitos/