A geometria octaédrica é o arranjo mais estável da natureza, na qual existe apenas um ângulo de ligação, equivalente a 90°. “O fenômeno do isomerismo cis-trans em química inorgânica é capaz de ilustrar, em termos de número de exemplos conhecidos, o progresso da química inorgânica sintética. De fato, desde os estudos realizados por Werner no início do século passado até os nossos dias, uma gama enorme de trabalhos envolvendo este tipo de isômeros vem sendo mencionada na literatura”1.
No que tange a complexos de coordenação, a geometria de coordenação octaédrica é também a mais comum, e ainda permite diversos tipos de estereoisomerismo. Uma estrutura octaédrica apresenta seis vértices; supondo-se que os seis vértices de um octaedro são equivalentes, torna-se possível apenas uma estrutura para complexos do tipo MA6 e MA5B, não possuindo esses isômeros geométricos.
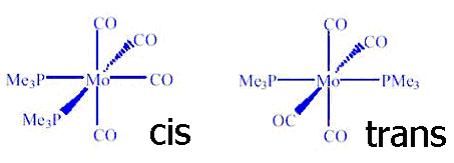
Já para o composto do tipo MA4B2, as estruturas cis e trans podem existir. No isômero cis os dois ligantes B ocupam os vértices adjacentes do octaedro, sendo que no trans estão nos vértices opostos, conforme pode ser visto na figura abaixo.
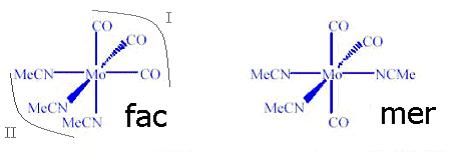
“O isomerismo geométrico do tipo cis-trans é observado quando dois grupos iguais ocupam posições adjacentes (cis) ou opostas (trans) um em relação ao outro em um complexo. Um grande número de exemplos ilustram esta situação na geometria octaédrica, podendo-se citar o exemplo clássico dos isômeros violeta (cis) e verde (trans) do [Co(NH3)4Cl2]+ Cl-, investigados por Werner. Na geometria quadrado planar isômeros cis e trans são também comuns, sendo a platina e o paládio metais onde observa-se com freqüência este fenômeno”1. Para os complexos de estrutura do tipo MA3B3, dois isômeros geométricos tornam-se possíveis, e esses são denominados facial (fac) e isômero meridional (mer). As faces, que dão nome ao isômero geométrico do tipo facial, estão mostradas a seguir, em I e II.
Conforme pôde ser observado, na geometria octaédrica distintos arranjos de ligantes podem dar origem a isômeros ópticos. Um exemplo simples é o composto [Mn(acac)3], no qual três ligantes bidentados, os acetilacetonatos (acac) trazem a existência de isômeros ópticos, no caso, de enantiômeros. Uma das maneiras de constatar-se os isômeros ópticos que se originam nos complexos desta natureza é tomar-se a vista de cima do eixo ternário, e observar o arranjo dos ligantes como uma hélice ou como uma espécie de rosca de parafuso.
Referências:
1. http://qnint.sbq.org.br/qni/visualizarConceito.php?idConceito=38
ATKINS, Peter; JONES, Loreta; Princípios de Química: questionando a vida moderna e o meio ambiente, Porto Alegre: Bookman, 2001.
EPSTEIN, Lawrence M.; ROSENBERG, Jerome l.; Química Geral, (Coleção Schaum), Porto Alegre: Bookman, 2003.
Texto originalmente publicado em https://www.infoescola.com/quimica/isomeria-em-complexos-de-numero-de-coordenacao-seis/