A ocorrência de ligações triplas não é algo incomum na natureza. O gás nitrogênio (N2), que compõe 78% do ar que respiramos, apresenta este tipo de ligação. As triplas ligações do gás nitrogênio, ao contrário das ligações apresentadas pelos compostos orgânicos, apresentam-se muito mais resistentes à interação química. Embora seja de extrema importância às plantas e esteja presente em pelo menos 4/5 do ar, este gás é relativamente inerte. Bactérias fixadoras, em simbiose com plantas, realizam o trabalho bioquímico de quebrar estas ligações e formar compostos nitrogenados, que são metabolizados pelo vegetal. No início do século XX, através dos estudos de Fritz Haber e Carl Bosch, iniciou-se a exploração deste gás atmosférico, através da síntese de amônia a partir dos gases nitrogênio e hidrogênio, sob condição bastante agressiva (alta pressão e alta temperatura).
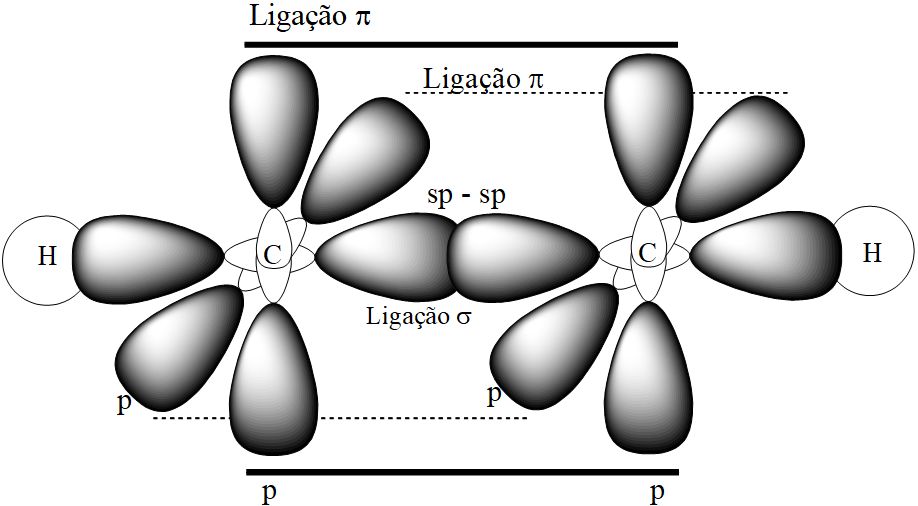
Encontradas em compostos orgânicos sintéticos, ligações triplas não são muito comuns nos seres vivos, embora se tenha isolado, já no século XX, compostos com ao menos uma tripla ligação em vegetais. Os compostos sintéticos são uma importante rota de síntese de moléculas de interesse e a classe correspondente de hidrocarbonetos que realizam triplas ligações, os alcinos, são importantes insumos industriais, tendo relevante participação na indústria de produção de plásticos. A tripla ligação dos alcinos apresenta uma ligação mais forte entre os carbonos (ligação sigma – σ), e outras duas ligações de menor energia (ligações pi – π). A hibridização desta classe de moléculas é a sp, e um modelo pode ser visualizado na figura a seguir:
A hibridização sp é diferente das hibridizações sp2 e sp3, em parte pela disponibilização de dois orbitais atômicos (os orbitais “p”) para interpenetração e consequente ligação química.
A síntese do etino (HC ≡ CH), representante mais simples dos compostos carbônicos que possuem triplas ligações, se dá das seguintes maneiras:
| Método | Condições |
| Síntese total | Eletrodos de carbono e atmosfera de hidrogênio |
| Hidrólise de carbetos de metais (famílias I e II) | Carbetos de metais alcalinos e alcalino-terrosos e água |
| Pirólise da molécula de metano | Metano e altas temperaturas (≈ 1500ºC) |
Síntese do etino – quadro geral
As propriedades físicas dos alcinos (temperaturas de fusão e ebulição) seguem, com algumas exceções, a regra da cadeia carbônica. Ou seja, conforme se aumenta a cadeia carbônica, aumentam-se as temperaturas de fusão e ebulição dos compostos.
Outra característica importante relativa à reatividade destes compostos pode ser encontrada na tabela a seguir:
| Processo | Molécula reagente/catalisadora | Produtos |
| Adição de halogênio | Cl2, Br2, I2 e catalisadores iônicos/metálicos | Haletos orgânicos insaturados (alcenos) ou saturados (alcanos) |
| Adição de hidrogênio | H2 | Alcenos e posteriormente, alcanos |
| Adição de haletos de hidrogênio | HI, HBr, HCl e catalisadores iônicos/metálicos | Haletos orgânicos insaturados |
| Adição de água | H2O e catalisadores metálicos em meio ácido | Aldeídos |
| Oxidação branda | KMnO4 em meio alcalino | α – dicetonas |
| Oxidação energética | KMnO4 em meio ácido | Ácidos carboxílicos |
| Reações com compostos que apresentam carbonila | Aldeídos e cetonas em meio alcalino | Álcool ou glicol |
| Reação de carbonilação I | CO2 e H2O em presença de catalisadores metálicos (Níquel) | Ácido acrílico |
| Reação de carbonilação II | CO2 e alcoóis ou aminas em presença do catalisador Níquel | Ésteres ou amidas oriundas do ácido acrílico |
Quadro com processos reacionais de alcinos
Diversos dos processos citados acima produzem alcenos utilizados na cadeia produtiva dos polímeros (plásticos), tornando-se os alcinos uma importante rota de produção de insumos à indústria química.
Referências:
CAMPOS, M.M; AMARAL, L.F.P. [et.al]. Fundamentos de Química orgânica. São Paulo: Edgard Blücher, 1980. p. 110 – 121.
LISBOA, J. C. F. Química, 3º ano: ensino médio. 1ª Ed. – São Paulo: Edições SM, 2010. (coleção Ser protagonista). p.60.
Texto originalmente publicado em https://www.infoescola.com/quimica/ligacao-tripla/