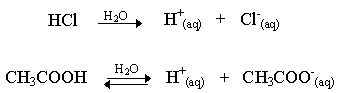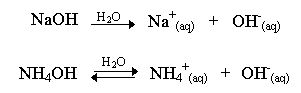Uma neutralização é a reação na qual um ácido neutraliza uma base, ou vice-versa. Entretanto, quando se considera uma neutralização total, alguns fatores precisam ser considerados, como a ionização do ácido empregado e a dissociação da base.
A ionização de um ácido representa a sua produção de íons em solução. Dessa forma, ácidos fortes terão alto coeficiente de ionização, e ácidos fracos terão baixo. Por exemplo, o ácido clorídrico (HCl) é um ácido forte, já o ácido acético (H3CCOOH) é um ácido fraco, o que indica que o primeiro, quando em solução, libera muitos íons, e o segundo libera poucos. Suas equações de ionização são respectivamente mostradas abaixo.
A dissociação de uma base representa a sua liberação de íons em solução. Assim, bases fortes liberam íons com facilidade, bases fracas com dificuldade, e em quantidade menor. Por exemplo, o hidróxido de sódio (NaOH) é uma base forte, já o hidróxido de amônio (NH4OH) é uma base fraca, o que sugere que a primeira libera mais íons em solução do que a segunda, mesmo quando ambas em mesmo número de moléculas. Suas equações de dissociação são respectivamente mostradas abaixo.
Para um ácido fraco neutralizar completamente uma base forte, em concentração semelhante, é necessário adicionar grande quantidade de ácido, porque só uma parte se ioniza para gerar íons H+, que são os responsáveis pela neutralização da base. Por exemplo: se pretendemos neutralizar uma solução de hidróxido de sódio, que é uma base forte, com uma solução de ácido acético, que é um ácido fraco, ambos de concentração semelhante, devemos adicionar grande quantidade de solução de ácido acético à solução de hidróxido de sódio, para que a neutralização da base seja completa. Quanto mais forte for o ácido, menor é a quantidade de material necessária à neutralização total da base.
De maneira semelhante, para um ácido forte ser completamente neutralizado por uma base fraca, é necessário acrescentar grande quantidade de base, porque ela se dissocia pouco e só uma pequena proporção de suas moléculas em solução fornece íons OH-, que irão efetivamente reagir com o ácido.
Já na neutralização de um ácido fraco por uma base fraca, ou vice-versa, de concentração semelhante, como o ácido fraco gera poucos íons H+ e a base também libera poucos íons OH- em solução, a neutralização total pode ser obtida com quantidades relativamente semelhantes das duas espécies. O mesmo se verifica quando se dispõe de um ácido e uma base, fortes.
Referências:
RUSSELL, John B.; Química Geral vol.1, São Paulo: Pearson Education do Brasil, Makron Books, 1994.
SARDELLA, Antônio; MATEUS, Edegar; Curso de Química: química geral, Ed. Ática, São Paulo/SP – 1995.
MAHAN, Bruce M.; MYERS, Rollie J.; Química: um curso universitário, Ed. Edgard Blucher LTDA, São Paulo/SP – 2002.
Texto originalmente publicado em https://www.infoescola.com/quimica/neutralizacao-ionizacao-e-dissociacao-de-acidos-e-bases/