O modelo atômico proposto por Thomson trazia o acréscimo da carga elétrica em relação aos seus antecessores, o que resolvia muitos problemas de natureza empírica para a época. Dessa forma, manteve-se inalterado e praticamente inquestionável durante quase uma década, tempo considerável para um assunto que acelerava muito no momento. O átomo proposto por Thomson trazia uma esfera positiva sobre a qual esferas menores estariam incrustadas, as quais eram desprendidas em fenômenos de natureza elétrica. Ficou, pelo seu formato, conhecido no mundo acadêmico como pudim de passas.
O átomo de Thomson, porém, assim como todos os propostos até então, era teórico, ou seja, não partia de dados experimentais. Em 1911, seu modelo de átomo sofreu uma mudança radical pelos trabalhos de Ernest Rutherford na Universidade de Manchester, apesar de Rutherford não ter essa intenção. No princípio do século XX ainda não se dispunha das modernas máquinas aceleradoras de partículas, quase comuns hoje em laboratórios de grande instituições, para produzir feixes de partículas com altas energias; se dispunha apenas de substâncias radioativas naturais como única fonte de partículas carregadas, as quais são as partículas alfa (formadas por núcleos de hélio) e as partículas beta (formadas por elétrons).
Rutherford, em 1911, viria a realizar um experimento que ficaria conhecido no mundo todo e até hoje povoaria os livros didáticos de química do mundo inteiro. Junto com seus colaboradores Geiger e Marsden, observava os efeitos de um feixe de partículas radioativas alfa sobre uma fina lâmina de ouro. Até então, muito pouco se conhecia a respeito das emissões radioativas, apenas se utilizava determinadas substâncias que apresentavam a propriedade de emissão e impregnação de filmes fotográficos, processo descoberto também por acaso.
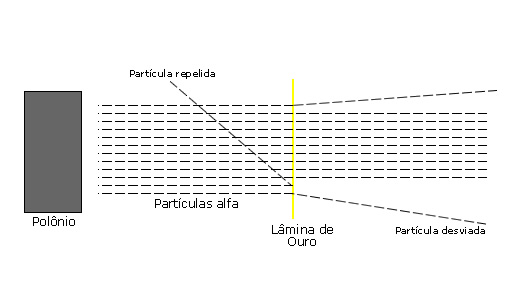 Sabe-se hoje que o objetivo principal da experiência realizada por Rutherford era observar as direções em que se desviavam as partículas ao atravessarem a folha de ouro, por meio de uma espécie de filme fotográfico que era colocado atrás da lâmina. Caso as partículas incidissem sobre essa lâmina e retornassem, estaria oferecendo subsídios experimentais ao modelo atômico de Thomson. Entretanto, sobretudo os elevados desvios observados nas partículas, colocava em xeque o modelo proposto por Thomson, que não era capaz de explicar a sua razão.
Sabe-se hoje que o objetivo principal da experiência realizada por Rutherford era observar as direções em que se desviavam as partículas ao atravessarem a folha de ouro, por meio de uma espécie de filme fotográfico que era colocado atrás da lâmina. Caso as partículas incidissem sobre essa lâmina e retornassem, estaria oferecendo subsídios experimentais ao modelo atômico de Thomson. Entretanto, sobretudo os elevados desvios observados nas partículas, colocava em xeque o modelo proposto por Thomson, que não era capaz de explicar a sua razão.
Se poderia explicar as observações somente a partir de um modelo novo para o átomo. Dessa forma, “o físico neozelandês Ernest Rutherford (1871 - 1937) realizou em 1911 um célebre conjunto de experiências que lhe permitiu concluir que o átomo é constituído por um minúsculo núcleo positivo circundado por uma região muitíssimo mais extensa, na qual está dispersa a carga negativa”1. Dessa forma, Rutherford concluiu suas experiências afirmando que toda a carga positiva, assim como toda a massa, de um átomo estavam concentradas em uma região extremamente pequena, o seu núcleo, sendo que a maior parte do átomo é composta pelo espaço vazio.
Leia mais:
Referências:
1. http://www.oocities.org/br/
PERUZZO, Francisco Miragaia (Tito); CANTO, Eduardo Leite; Química na Abordagem do Cotidiano, Ed. Moderna, vol.1, São Paulo/SP- 1998.
SARDELLA, Antônio; MATEUS, Edegar; Curso de Química: química geral, Ed. Ática, São Paulo/SP – 1995.
Texto originalmente publicado em https://www.infoescola.com/quimica/o-vazio-de-rutherford/