Os compostos de Grignard pertencem à classe dos organometálicos, que são substâncias que apresentam átomos de metais ou semimetais ligados diretamente ao átomo de carbono de uma cadeia orgânica. No caso dos compostos de Grignard, o metal é o átomo de magnésio e por isso apresentam a fórmula geral R-Mg-X, onde R refere-se ao radical orgânico. Esses compostos são derivados de hidrocarbonetos onde um dos hidrogênios da cadeia carbônica é substituído por um radical MgX, sendo X um dos halogênios, F, Cl, Br ou I. Vale ressaltar aqui que para ser considerado um composto de Grignard é imprescindível que o átomo de magnésio esteja ligado ao átomo de carbono. Os reagentes de Grignard são utilizados em diversas reações de síntese orgânica reagindo com aldeídos para produzir alcoóis secundários, alguns exemplos de compostos são: CH3MgCl, CH3CH2MgCl, CH3CH2CH2MgBr e C6H5MgBr. De maneira geral, esses compostos se caracterizam por serem bastante tóxicos. Em relação as suas propriedades físico-químicas, são considerados bastante densos em comparação a água, insolúveis, reagindo de forma violenta em meio aquoso e na presença de oxigênio. Dessa forma, devem ser armazenados em recipiente fechado com éter etílico. Em temperatura ambiente esses compostos de encontram no estado sólido, apresentando elevados pontos de fusão e ebulição, características essas que estão relacionadas com o fato de apresentarem ligações covalentes e iônicas (ligação que se forma entre os átomos de magnésio e o halogênio).
Em relação à nomenclatura, os compostos de Grignard são nomeados de acordo com regras estabelecidas pela IUPAC. Para isso devemos seguir o esquema descrito a seguir:
Nome anion do halogênio de + nome do radical orgânico + magnésio.
Para ficar mais claro, vejamos alguns exemplos:
- H3C – MgCl – na formula temos o átomo de cloro, então seu anion será o cloreto, ligado ao radical orgânico com 1 átomo de carbono, cujo nome é metil, dessa forma, seguindo a sequencia abaixo teremos:
Nome anion do halogênio (Cloreto) de + nome do radical orgânico (Metil) + magnésio. Com isso o nome fica cloreto de metil-magnésio
- H3C – H2C – H2C – MgBr – nesse caso, o anion do halogênio é o brometo, e o radical orgânico é o propril, dessa forma o nome será brometo de propil magnésio.
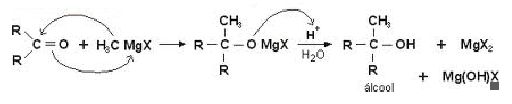
Em relação as suas aplicações, os compostos de Grignard são bastante empregados em sínteses orgânicas. Entre essas aplicações podemos destacar a reação com composto contendo carbonilas, uma acetona ou aldeído, para a formação de alcoóis.
Podemos também mencionar a preparação de compostos de diversos metais tais como chumbo, arsênio, silício, boro, alumínio, estanho, prata, ouro, mercúrio, fosforo, platina, utilizando os reagentes de Grignard. Outras aplicações envolvem as reações de hidrólise de haletos de alquil-magnésio na síntese de hidrocarbonetos parafínicos e olefinas, ou ainda produção de aldeídos através da reação com ésteres de ácido, ou síntese de ácidos carboxílicos através da reação com gás carbônico em meio de éter.
De maneira geral, as reações de Grignard são exotérmicas, com energia de ativação relativamente alta, em função da camada de óxido presente no composto de magnésio.
Referências
Química Volume 3, Química Orgânica 6º edição, Ricardo Feltre, Editora FTD , São Paulo, 2004.
Tito e Canto. Química na Abordagem do Cotidiano. Volume único, parte C – Química Orgânica. Editora Saraiva 2005.
T. W. Graham Solomons. QUÍMICA. ORGÂNICA volume 1; Sétima edição. Editora LTC livros técnico e científicos, 2000.
T. W. Graham Solomons. QUÍMICA. ORGÂNICA volume 2; Sétima edição. Editora LTC livros técnico e científicos, 2000.
Texto originalmente publicado em https://www.infoescola.com/quimica/reacoes-de-grignard/