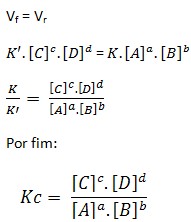As reações químicas raramente atingem 100% de eficiência. Pois sempre há produtos restituindo os reagentes de origem. Assim, pode-se afirmar que toda reação é reversível, mesmo que essa reversibilidade seja quase nula.
É essa reversibilidade que determina, por exemplo, o rendimento de uma reação (quantidade de produto em relação à de reagentes) ou a força de um ácido ou base (a partir da ionização e dissociação dos mesmos).
Como exemplo, observe a reação de dissociação do ácido clorídrico quando perde um próton (H+) para a molécula de água:
HCl(aq) + H2O(l) → H3O+(aq) + Cl-(aq)
Apesar de o sentido da reação ser indicada por uma seta única, não é o jeito mais correto. Pois é verificado experimentalmente que a reação não ocorre com a dissociação total do ácido: uma parte sempre permanece na forma molecular (cerca de 8%).
Equilíbrio Químico
Retomando a reação de desprotonação do ácido clorídrico, a melhor forma de representá-la é:
HCl(aq) + H2O(l) ⇌ H3O+(aq) + Cl-(aq)
O símbolo da seta dupla (⇌) significa que a reação ocorre nos dois sentidos. E que, portanto, é reversível.
A formação de H3O+ e Cl- ocorre a uma determinada velocidade, do mesmo modo que os reagentes são restituídos também com uma velocidade (inicialmente, diferente da primeira). Onde, quando estas se igualam, o chamado equilíbrio químico é atingido; indicando que a taxa de formação dos produtos é a mesma que a de restituição dos reagentes.
A partir desse ponto de equilíbrio, por mais tempo que deixemos, o rendimento da reação continuará o mesmo e o processo de ionização / dissociação do ácido estagna.
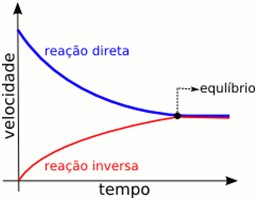
Após o equilíbrio ser atingido, a velocidade de formação dos produtos se torna igual a de restituição dos reagentes
A constante de equilíbrio de uma reação dá-se em função da concentração dos produtos e reagentes, e dos coeficientes estequiométricos de cada um.
Para a reação genérica: aA + bB ⇌ cC + dD
Tem-se o seguinte valor de constante de equilíbrio: 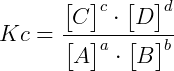
Para a reação de dissociação do ácido clorídrico, o valor da constante de equilíbrio é: 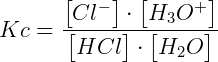
Caso utilizássemos as equações das velocidades de cada reação (direta e inversa), chegaríamos ao mesmo valor de Kc.
Considerando a reação genérica: aA + bB ⇌ cC + dD
Tem-se a velocidade de formação dos produtos: 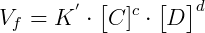
Onde K’ é uma constante que varia com a reação e a temperatura.
Para a velocidade de restituição dos reagentes: 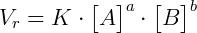
Onde K também é uma constante (diferente ou não de K’) que varia com a reação e a temperatura.
Sabendo-se que, no equilíbrio, as velocidades de formação e restituição se igualam, tem-se:
Texto originalmente publicado em https://www.infoescola.com/quimica/reversibilidade-das-reacoes/