A Tonoscopia, ou como também é conhecida, Tonometria, é uma Propriedade Coligativa que está diretamente relacionada à diminuição da pressão máxima de vapor de um solvente ocasionada pela adição de um soluto não – volátil.
Em meados de 1887, o físico-químico francês François Marie Raoult (1830 – 1901), iniciou os estudos relacionados à pressão de vapor de solventes em sistemas fechados e observou que a pressão máxima de vapor de um líquido quando em solução é diretamente relacionado à quantidade de soluto não volátil presente na solução, e que a pressão máxima de vapor é diminuída quando aumentada a concentração de soluto. A lei de Raoult é somente aplicada à soluções moleculares.
A pressão máxima de vapor de uma substância é a maior pressão que os vapores da mesma exercem em uma determinada temperatura, ou seja, quando há a evaporação de um determinado solvente, há o rompimento das ligações intermoleculares, fazendo o vapor evadir-se da massa líquida.
Para entendermos melhor este princípio, vamos falar um pouco sobre equilíbrio dinâmico: Em um sistema fechado, onde não há troca de matéria com o meio externo, de acordo com cada temperatura alcançada, em determinado momento, após o equilíbrio dinâmico, não há alteração no grau de saturação das moléculas de vapor do solvente, ou seja, se uma molécula de vapor passa para o estado líquido, uma que está no estado líquido volta para o estado de vapor ao mesmo tempo.
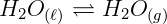
É devido a esse fenômeno que, nas embalagens de água que compramos em mercados não há variação do volume dentro do recipiente, pois trata-se de um sistema fechado em equilíbrio dinâmico constante, mesmo quando expostas ao sol.
Ao adicionarmos um soluto não volátil à um solvente, haverá a diminuição da pressão máxima de vapor, consequentemente, o tempo de evaporação do solvente será aumentado, isso ocorre, pois, as partículas do soluto intensificam as forças de atração intermoleculares, portanto, quanto maior a quantidade de partículas na solução, menor a pressão de vapor da mesma. A pressão máxima de vapor da água em solução é menor que a pressão máxima de vapor da água pura.
A fórmula para o cálculo da Tonoscopia é representada pela seguinte fórmula:
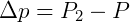
Onde:
- Δp = Abaixamento absoluto da pressão máxima de vapor
- P2 = Pressão de vapor do solvente
- P = Pressão de vapor da solução
Se a pressão externa e a pressão interna do sistema se igualam, o líquido entra em ebulição, é o que ocorre quando abrimos a panela de pressão após cozinhar um alimento, enquanto a panela está fechada, a pressão interna é maior que a externa, ao retirarmos a pressão através do escape ou válvula, há variação de pressão, até o momento em que ambas se igualam, e o líquido de dentro da panela entra em ebulição.
Dentro da panela de pressão, há o aumento da temperatura, que pode chegar à 120°C e também da pressão interna, que se aproxima de 2 atm, fazendo com que os alimentos cozinhem mais rápido que em panelas comuns.
Referências:
FONSECA, M.R.M. da. Química 2. 1. ed. São Paulo: Ática, 2013.
Texto originalmente publicado em https://www.infoescola.com/quimica/tonoscopia/