A ureia, CO(NH2)2 é uma carbamida que apresenta-se como cristais brancos, solúvel em água, álcool e benzeno. Pode ser obtida pelo aquecimento do cianato de amônio ou tratando-se a cianamida cálcica com ácidos diluídos. Usada na medicina e em pesquisas bioquímicas, serve também como estabilizador de explosivos e plásticos. Possui aplicação importante para a agricultura, representando alta concentração de nitrogênio.
É o produto final do metabolismo do nitrogênio no organismo dos mamíferos, sendo excretada pela urina. Encontra-se também no sangue, bem como em plantas e cogumelos. Sua síntese in vitro foi conseguida por Wöhler em 1828 partindo de substâncias puramente inorgânicas, o que derrubou a teoria da força vital como única formadora de produtos orgânicos.
A ureia presta-se muito bem para algumas experimentações, conforme descrito abaixo:
A) A solução de partida deve ser 3 mols/L de ureia.
B) Liberação de moléculas gasosas.
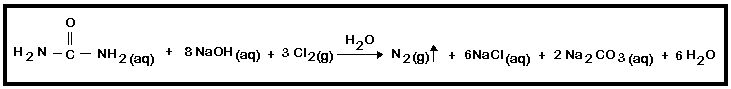
1. N2: A água sanitária é uma solução que contém NaClO, NaOH e Cl2 em água. A ureia reage com a água sanitária segundo equação abaixo:
- Adicionar a um erlenmeyer 20mL da solução de ureia anteriormente preparada e a seguir 30mL de água sanitária (hipoclorito de sódio). Testar inflamabilidade do gás produzido e anotar observações.
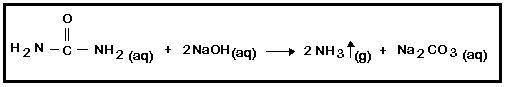
2. NH3: A ureia reage com o hidróxido de sódio liberando o gás amônia, que possui um odor forte e desagradável, conforme a equação abaixo:
- Em um erlenmeyer, adicionar 20mL de solução 3M de ureia e 20mL de solução de hidróxido de sódio 3M. Homogeneizar e observar por 5 minutos. Anotar observações.
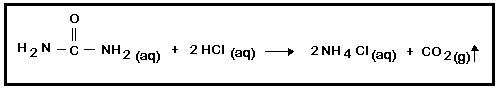
3. CO2: A ureia reage com o ácido clorídrico, liberando gás carbônico, conforme equação abaixo:
- Em um erlenmeyer, adicionar 20mL de solução 3M de ureia e 20mL de solução de ácido clorídrico 3M. Homogeneizar e observar por 5 minutos. Anotar observações.
C) Reações de polimerização.
- Obtém-se um plástico ureia-formol pela condensação de ureia a aldeído fórmico em presença de ácido bórico.
- Colocar 3g de ureia, 4mL de formol e 0,2g de ácido bórico em um tubo de ensaio. Agitar.
- Colocar 100mL de água no erlenmeyer e este em uma tela de amianto, aquecendo a água até ebulição em um bico de Bunsen.
- Segurar o tubo de ensaio com a pinça de madeira. Introduzir o fundo do tubo de ensaio no erlenmeyer de maneira que receba o vapor de água produzido na ebulição. Mantê-lo nesta posição até plastificação. Irá formar-se um plástico pulverulento.
- Em uma pequena lata, adicione um pouco de uréia e um pouco de formol, suficiente para dissolver a uréia. Acrescente aproximadamente 1mL de ácido clorídrico concentrado, gota a gota. A solução irá ferver (não aquecê-la). Em seu resfriamento o plástico produzido estará no fundo.
Referências:
LUFTI, Mansur; Os Ferrados e os Cromados: produção social e apropriação privada do conhecimento químico, Ed. UNIJUI, Ijuí/RS – 1992.
PERUZZO, Francisco Miragaia (Tito); CANTO, Eduardo Leite; Química na Abordagem do Cotidiano, Ed. Moderna, vol.1, São Paulo/SP- 1998.
Texto originalmente publicado em https://www.infoescola.com/compostos-quimicos/ureia/