O metanol, nome oficial de acordo com a União Internacional de Química Pura e Aplicada (IUPAC), é um composto orgânico pertencente às funções oxigenadas por apresentar átomos de carbono, hidrogênio e oxigênio. O mesmo possui alguns nomes não oficiais como álcool de madeira ou espírito da madeira, pois pode ser produzido por meio da destilação da madeira. Contudo, também pode ser encontrado com os nomes de metil carbinol, hidróxido de metila e hidrato de metila.
A metodologia de fabricação mais comum do metanol é a sua obtenção industrial por meio de uma reação catalisada entre o monóxido de carbono e o hidrogênio, conforme indicado na equação a seguir:

Com fórmula molecular CH3OH e massa molar de 32,04 g mol-1, possui o grupo funcional hidroxila (-OH) ligado diretamente a um átomo de carbono saturado. Devido à presença do grupo hidroxila as moléculas do metanol, como todos os compostos desse grupo, apresentam forças de atração eletrostáticas muito intensas. Essas atrações promovem interações moleculares do tipo ligações de hidrogênio, isto é, quando o hidrogênio realiza interações com átomos de flúor, oxigênio ou nitrogênio. Como a atração é muito intensa, consequentemente, a temperatura de fusão e ebulição desses compostos são elevadas.
De acordo com suas propriedades físico-químicas é um líquido inflamável, incolor, ponto de fusão/congelamento - 97,5 ◦C, ponto de ebulição 64,7 ◦C a 760 mmHg e densidade 0,792 g/ml a 20 ◦C. É um solvente polar, solúvel em água, álcool etílico, éter, acetona, clorofórmio e com odor alcoólico levemente adocicado.
O metanol é empregado em várias áreas industriais. Pode ser utilizado na fabricação de inseticidas, tintas, corantes, resinas, adesivos e insumo para a produção de metanal. No Brasil, a mistura de metanol à gasolina é ilegal devido à sua alta toxicidade. Com isso, seu emprego é restrito às sínteses orgânicas.
Na espécie humana sua absorção ocorre pela via digestiva, respiratória ou pele. Caso uma pessoa consuma cerca de 30 a 100 ml do solvente pode ser fatal. Uma vez no corpo humano, sucede a sua biotransformação oxidando e gerando metabólicos como metanal e ácido metanoico, que interferem no sistema nervoso, fígado e no nervo óptico, causando cegueira. Na figura abaixo pode-se observar as reações de oxidação do metanol à metanal e ácido metanoico.
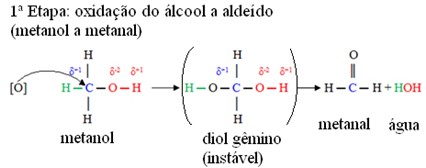
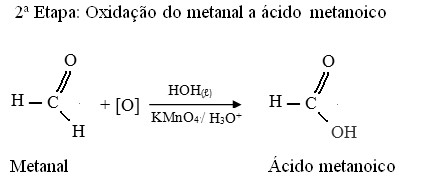
Etapas de oxidação do metanol à metanal e ácido metanoico. Fonte: ANTUNES; NOVAIS, 2016.
Gradualmente o metanol tem sido substituído em alguns processos industriais. Na produção de biodiesel, por exemplo, é utilizado no processo de esterificação dos ácidos graxos. No entanto, por meio de vários estudos de otimização de processos, tem-se utilizado o etanol, que além de ser menos tóxico é produzido por meio da fermentação da cana-de-açúcar, considerado um insumo químico verde.
Fontes:
ANTUNES, Murilo Tissoni; NOVAIS, Vera Lúcia Duarte de. Vivá: química: volume 3: ensino médio. – Curitiba: Positivo, 2016.
FONSECA, Martha Reis Marques da. Química: ensino médio. – 2. Ed. – São Paulo: Ática, 2016.
Texto originalmente publicado em https://www.infoescola.com/compostos-quimicos/metanol/