O termo espécie química se refere às diversas formas com quais substâncias químicas correlacionam-se na natureza ou numa reação: os átomos (para substâncias elementares), os íons (para átomos com deficiência ou excesso de elétrons, bem como íons complexos), as moléculas (para um agrupamento neutro de átomos) e os radicais (para um agrupamento de átomos, também neutro, mas decorrente da cisão homolítica de uma ligação covalente de uma molécula).
Conteúdo deste artigo
Átomos
Os átomos são a espécie química mais elementar que é capaz de participar de uma reação e formar compostos ou substâncias. Por exemplo: o átomo de oxigênio ao combinar-se com outro, forma a substância oxigênio. Assim como, ao combinar-se com o carbono forma o composto monóxido de carbono.
Representação artística do átomo de Bohr
Íons
Íons são espécies químicas originadas de átomos com deficiência ou excesso de elétrons. Assim, possuem carga elétrica positiva (denominados cátions) ou negativa (ânions) e são capazes de formar compostos sólidos (como sais) por simples atração eletrostática (utilizando-se das leis de Coulomb para a força elétrica).
A massa de um íon é praticamente a mesma de seu átomo correspondente (pois, como o elétron é mais de 1800 vezes mais leve que o próton, a diferença de massa é insignificante caso ocorra sua perda ou ganho).
Os compostos iônicos são formados pela atração de íons de carga oposta, apresentando, então, carga total neutra (Ex.: cloreto de sódio – NaCl). Geralmente, são sólidos nas condições ambiente e possuem altos pontos de fusão e ebulição.
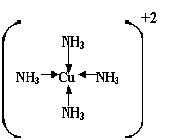
Quando um íon não é elementar, mas um arranjo de outros íons envolta de um central ou um íon central rodeado de moléculas neutras, denomina-se complexo. Onde, mesmo que se assemelhe geometricamente a uma molécula, é dotado de carga total diferente de zero. Normalmente, um cátion metálico (de transição ou não) assume a posição central do complexo.
Moléculas e Radicais
A combinação de dois ou mais átomos constitui a molécula (exceto se esses átomos apresentarem ligação covalente metálica e não covalente molecular entre si). Esta, é caracterizada por possuir carga total neutra. E, só consegue conduzir corrente elétrica em meio aquoso caso seja passível de sofrer ionização: uma molécula de HCl, por exemplo, conduz corrente elétrica. Ao passo que uma de glicose (C6H12O6), não.
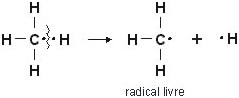
Um radical é originado pela cisão homolítica de uma ligação covalente dentro de uma molécula, ou seja, durante a quebra de uma ligação nenhuma das partes adquire carga elétrica. Pois o par eletrônico é igualmente dividido.
O esquema abaixo representa a formação do radical metila:
Assim, uma molécula de metano é seccionada em CH3. e .H. Observe que tanto o carbono quanto o hidrogênio voltam a possuir os respectivos elétrons que estavam compartilhando, sem o ganho ou perda deles.
Fontes:
http://www.quimica.icen.ufpa.br/formacao de complexos aquosos.htm
Texto originalmente publicado em https://www.infoescola.com/quimica/especie-quimica/