Por Luiz Molina Luz
Os átomos dos gases N2 e O2 estão unidos por meio de ligação covalente. Para entender esse tipo de ligação, vamos analisar, antes, o gás cloro (Cl2).
Nesse gás, dois átomos de cloro estão unidos. Isso acontece porque o cloro apresenta apenas sete elétrons na camada de valência (3s2 3p5), sendo, assim, um átomo instável.
17Cl: 1s2 2s2 2p6 3s2 3p5
Sua estabilidade é atingida ao se unir, por exemplo, a outro átomo de cloro. Aproximando-se de outro átomo de cloro, os dois podem compartilhar um par de elétrons. O par de elétrons passa, então, a “pertencer” simultaneamente aos dois átomos. A atração dos núcleos sobre esse par de elétrons compartilhados é que mantém os átomos unidos. Esse compartilhamento é chamado Ligação covalente, um tipo de ligação que ocorre sempre entre átomos ametálicos, pois eles são muito eletronegativos e quase nunca doam seus elétrons. Nesse caso, ocorreu ligação entre dois átomos de um mesmo elemento químico (Cl) e formou-se uma molécula (Cl2).
Representação de Lewis, onde dentro da ogiva consta um par de elétrons compartilhado:
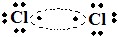
Veja as fórmulas estrutural e molecular abaixo, respectivamente:
Cl─Cl e Cl2
Podemos concluir que:
Ametal + Ametal → Ligação Covalente → Substância molecular → Sólido ou Líquido ou Gás
Analogamente, podemos dizer que, para atingir o octeto, os ametais do grupo 6A(16) devem compartilhar dois pares de elétrons; os do grupo 5A(15), três pares; e os do 4A(14), quatro pares.
Agora, podemos montar as fórmulas estruturais eletrônicas dos gases N2 e CO2, respectivamente:

Leia também:
Texto originalmente publicado em https://www.infoescola.com/quimica/ligacao-covalente-simples-ligacao-molecular/