A teoria do octeto ou regra do octeto fundamenta-se a partir da tendência de os átomos realizarem ligações de modo a preencherem completamente a camada mais externa possível com exatamente 8 elétrons: sendo essa a configuração eletrônica dos gases nobres, os elementos menos reativos da tabela periódica (justamente pela sua “estabilidade” perante os outros elementos).
Pela sua configuração eletrônica e energética, os gases nobres (pelo menos alguns, como o xenônio) só se ligam a outros átomos em condições especiais de temperatura e pressão. E, mesmo assim, os compostos formados não são, de fato, duradouros (são instáveis).
O hélio é o único elemento cujos átomos possuem 2, e não 8, elétrons na camada de valência.
Ionização
Apesar de a forma mais “natural” de um átomo completar o octeto ser através de uma ligação química, esse estado pode ser atingido com o fornecimento de energia para a adição, ou remoção, de elétrons. Portanto, as propriedades periódicas de cada elemento podem relacionar justamente a facilidade com que determinado átomo de determinado elemento consegue ganhar ou perder elétrons (afinidade eletrônica – energia liberada, ou absorvida, ao receber um elétron no estado fundamental e gasoso, e potencial de ionização – energia mínima necessária para que um elétron seja retirado de um átomo no estado fundamental e gasoso).
Assim, considerando que o flúor possui alto valor absoluto de afinidade eletrônica e um valor relativamente alto de potencial de ionização, pode-se afirmar que a espécie F- é mais “estável” (estável no contexto energia/preenchimento eletrônico) que o átomo F. Ou seja, se conseguirmos adicionar um elétron à eletrosfera do átomo de flúor, faremos com que o mesmo torne-se similar a um gás nobre, o neônio, (sem necessitar que esteja ligado a outro átomo).
Da mesma forma, considerando que o sódio possui alto valor absoluto de afinidade eletrônica e baixo valor de potencial de ionização, se conseguirmos remover o elétron mais externo de sua eletrosfera, também faremos com que adquira condição semelhante aos gases nobres (nesse caso, também o neônio).
Restrições à Teoria
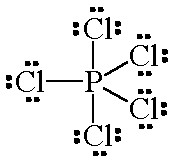
Apesar de a regra do octeto ser aplicável a maioria das estruturas químicas, alguns casos não a seguem. Um exemplo é o PCl5 (o fósforo contém 10 elétrons na camada de valência), justificável pelo fato de que os átomos que possuem orbitais nd ou (n-1)d disponíveis, conseguem expandir a camada de valência e “acomodar” mais elétrons que o necessário para atingir a condição energética de um gás nobre.
Essa expansão não é válida para átomos de elementos dos grupos 1 e 2 da tabela, pois não existem orbitais 1d ou 2d e os orbitais 3d não estão disponíveis, pois apresentam energia muito alta.
Bibliografia:
RUSSEL, John Blair. Química Geral, 2ª edição. São Paulo: Pearson Makron Books, 1994. Volume I.
Texto originalmente publicado em https://www.infoescola.com/quimica/teoria-do-octeto/