As propriedades periódicas dos elementos químicos são as características inerentes à esses elementos que variam de acordo com sua posição na tabela periódica, ou seja, com o número atômico.
As propriedades periódicas são: eletronegatividade, eletropositividade, raio atômico, afinidade eletrônica, potencial de ionização, densidade atômica, volume atômico, temperatura de fusão e temperatura de ebulição. As quatro últimas propriedades muitas vezes são consideradas aperiódicas por apresentarem um certo desordenamento: o volume atômico cresce, no período, do centro para as extremidades; as temperaturas de fusão e ebulição crescem com o raio atômico nas famílias da esquerda (1A e 2A), e decrescem nas da direita (gases nobres e halogênios).
As propriedades mais estudadas são:
Conteúdo deste artigo
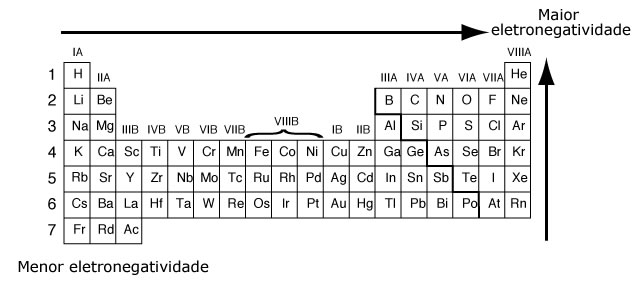
Eletronegatividade
A eletronegatividade é a tendência que um átomo tem em receber elétrons em uma ligação química, logo, não pode ser calculada a eletronegatividade de um átomo isolado.
A escala de Pauling, a mais utilizada, define que a eletronegatividade cresce na família de baixo para cima, devido à diminuição do raio atômico e do aumento das interações do núcleo com a eletrosfera; e no período da esquerda pela direita, acompanhando o aumento do número atômico.
O flúor é o elemento mais eletronegativo da tabela periódica.
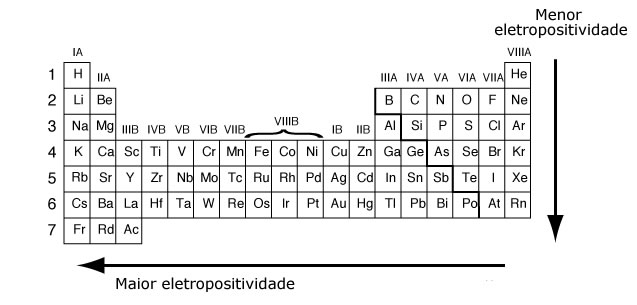
 Eletropositividade
Eletropositividade
A forma da medição da eletropositividade é a mesma da eletronegatividade: através de uma ligação química. Entretanto, o sentido é o contrário, pois mede a tendência de um átomo em perder elétrons: os metais são os mais eletropositivos.
A eletropositividade cresce no sentido oposto da eletronegatividade: de cima para baixo nas famílias e da direita para a esquerda nos períodos.
O frâncio é o elemento mais eletropositivo, logo, tem tendência máxima à oxidação.
 Obs.: Como os gases nobres são muito inertes, os valores de eletronegatividade e eletropositividade não são objetos de estudo pela dificuldade da obtenção desses dados.
Obs.: Como os gases nobres são muito inertes, os valores de eletronegatividade e eletropositividade não são objetos de estudo pela dificuldade da obtenção desses dados.
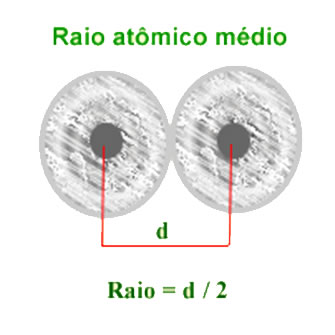
Raio Atômico
Raio atômico é, basicamente, a distância do núcleo de um átomo à sua eletrosfera na camada mais externa. Porém, como o átomo não é rígido, calcula-se o raio atômico médio definido pela metade da distância entre os centros dos núcleos de dois átomos de mesmo elemento numa ligação química em estado sólido:
O raio atômico cresce na família de cima para baixo, acompanhando o número de camadas dos átomos de cada elemento; e, nos períodos, da direita para a esquerda.
Quanto maior o número atômico de um elemento no período, maiores são as forças exercidas entre o núcleo e a eletrosfera, o que resulta num menor raio atômico.
O elemento de maior raio atômico conhecido é o Césio, entretanto, é muito provável que o Frâncio tenha um maior raio atômico, porém isto ainda não foi confirmado, em razão da raridade deste elemento na natureza.
Afinidade Eletrônica
A afinidade eletrônica mede a energia liberada por um átomo em estado fundamental e no estado gasoso ao receber um elétron. Ou ainda, a energia mínima necessária para a retirada de um elétron de um ânion de um determinado elemento.
Nos gases nobres, novamente, a afinidade eletrônica não é significativa. Entretanto, não é igual a zero: já que a adição de um elétron em qualquer elemento causa liberação de energia.
A afinidade eletrônica não tem uma forma muito definida no seu crescimento na tabela periódica, mas seu comportamento é parecido com a eletronegatividade: cresce de baixo para cima e da esquerda para a direita.
O Cloro possui maior afinidade eletrônica: cerca de 350 KJ/mol (em módulo).
Potencial de Ionização
O potencial de ionização mede o contrário da afinidade eletrônica: a energia necessária para retirar um elétron de um átomo neutro, em estado fundamental e no estado gasoso. Sendo que, para a primeira retirada de elétron a quantidade de energia requerida é menor que a segunda retirada, que por sua vez é menor que a terceira retirada, e assim sucessivamente.
Apresenta mesmo comportamento da afinidade eletrônica e da eletronegatividade. Logo, pode-se afirmar que o Flúor e o Cloro são os átomos com os maiores potenciais de ionização da tabela periódica, já que são os elementos com os maiores valores de afinidade eletrônica da tabela periódica.
Fontes:
MAHAN Bruce M., MYERS Rollie J. Química: um curso universitário, São Paulo – SP: Editora Edgard Blücher LTDA, 2005. 4ª tradução americana, 7ª reimpressão. 592 págs.
Texto originalmente publicado em https://www.infoescola.com/quimica/propriedades-periodicas-dos-elementos/