Há diversas teorias de como os átomos se unem formando compostos químicos. As primeiras foram apresentadas pelo cientista suíço Torbern Olof Bergman (1735-1784) e mais tarde pelo químico francês Marcelin Berthellot (1827 – 1907), com base na força de atração gravitacional e das massas dos átomos. Com os estudos de mecânica quântica verificou-se que existe uma tendência pela busca de estabilidade segundo a teoria do octeto, por esse motivo, os elementos químicos combinam-se e realizam as ligações químicas na busca pela estabilidade eletrônica.
Linus Pauling, em 1920, leu um artigo de Gilbert Newton Lewis, que falava sobre uma teoria chamada “Chemical bond”, que tratava sobre como os elementos químicos se unem formando substâncias simples e compostas que se mantém estáveis por milhares de anos. Com essa leitura, Pauling dedicou-se a investigar mais sobre as ligações químicas e o que impedia o mundo de se desmanchar.
A ligação covalente é um tipo de ligação química onde os átomos compartilham os elétrons entre si, de forma que ambos se tornam estáveis, e não há a transferência de elétron(s) de um átomo para o outro. Geralmente a ligação covalente ocorre nos elementos químicos que possuem de 4 a 7 elétrons em sua camada de valência, sendo mais comum ocorrer este tipo de ligação entre elementos não metálicos. Há casos em que há a ligação covalente entre metais e entre metais e ametais, mas esse tipo de fenômeno ocorre com menor frequência.
Existem alguns tipos diferentes de ligações covalentes, que serão detalhadas a seguir, utilizando-se a representação eletrônica de Lewis para facilitar o entendimento:
- Ligação covalente simples
- Ligação covalente dupla
- Ligação covalente tripla
- Ligação covalente coordenada ou dativa
Conteúdo deste artigo
Ligação covalente simples
Neste tipo de ligação covalente, os átomos “dividem” um elétron de cada elemento buscando a estabilidade de ambos, de acordo com a regra do octeto. Na formação do gás cloro (Cl2), há o compartilhamento de um elétron de cada átomo de Cloro:
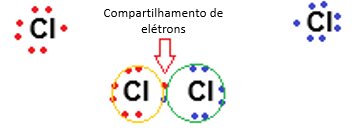
Ligação covalente dupla
Neste tipo de ligação covalente, os átomos “dividem” dois elétrons de cada elemento buscando a estabilidade de ambos, de acordo com a regra do octeto. O dióxido de carbono (CO2) possui duas ligações duplas, cada oxigênio compartilha dois elétrons com o átomo de carbono.
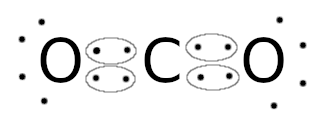
Ligação covalente tripla
Neste tipo de ligação covalente, os átomos “dividem” três elétrons de cada elemento buscando a estabilidade de ambos, de acordo com a regra do octeto. No caso do gás nitrogênio (N2), quando há a formação da molécula do gás, há o compartilhamento de três elétrons de cada átomo de nitrogênio entre si:
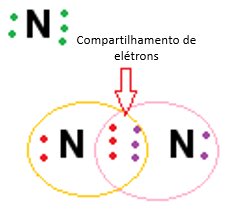
Ligação covalente coordenada ou dativa
Neste tipo de ligação covalente, os átomos “dividem” os elétrons da camada de valência e, quando há pares de elétrons disponíveis, é feito a “doação” destes elétrons com outro átomo, é o que ocorre com o dióxido de enxofre (SO2), quando há a formação da molécula do gás, há o compartilhamento de dois elétrons de oxigênio com um átomo de enxofre e há a doação de um par de elétrons do oxigênio para outro átomo de enxofre:
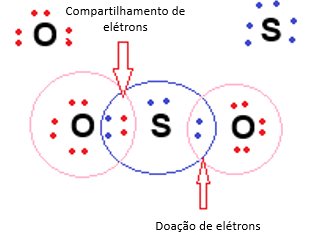
Referências bibliográficas:
BIANCHI, J. C. de A. Universo da Química: Ensino Médio: Volume único. 1. Ed. São Paulo: FTD, 2005.
SANTOS, W. L. P.dos.; MOL, G. de S. Química Cidadã: Volume 1: Ensino Médio. 2. ed. São Paulo: AJS, 2013.
FONSECA, M.R.M. da. Química 1. 1. ed. São Paulo: Ática, 2013.
Texto originalmente publicado em https://www.infoescola.com/quimica/ligacao-covalente/