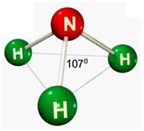
A geometria molecular baseia-se na forma espacial que as moléculas assumem pelo arranjo dos átomos ligados. Assim, cada molécula apresenta uma forma geométrica característica da natureza das ligações (iônicas ou covalentes) e dos constituintes (como elétrons de valência e eletronegatividade).
Conteúdo deste artigo
Teoria da Repulsão dos Pares Eletrônicos
A teoria da repulsão dos pares eletrônicos de valência (TRPEV) aponta que os pares eletrônicos (elétrons de valência, ligantes ou não) do átomo central se comportam como nuvens eletrônicas que se repelem e, portanto, tendem a manter a maior distância possível entre si. Mas, como as forças de repulsão eletrônica não são suficientes para que a ligação entre os átomos seja desfeita, essa distância é verificada no ângulo formado entre eles.
Formas Geométricas
Para que se torne mais fácil a determinação da geometria (e, estrutura) de uma molécula, deve-se seguir os seguintes passos:
- Contagem do número total de elétrons de valência (levando em consideração a carga, se for um íon);
- Determinação do átomo central (geralmente, o menos eletronegativo e com o maior número de ligações);
- Contagem do número de elétrons de valência dos átomos ligantes;
- Cálculo do número de elétrons não ligantes (diferença entre número total e o número de elétrons dos átomos ligantes com a camada de valência totalmente completa);
- Aplicação do modelo da TRPEV.
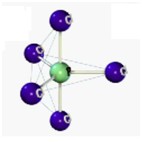
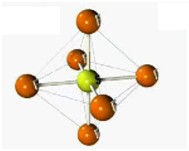
Desse modo, as geometrias mais comuns obtidas (observando-se, principalmente, os pares eletrônicos não ligantes) são:
| Geometria | Pares eletrônicos totais | Pares eletrônicos não ligantes | Pares eletrônicos ligantes |
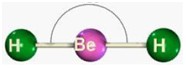
| Linear | 2 5 6 |
0 3 4 |
2 2 2 |
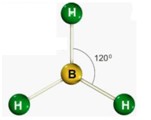
| Triangular | 3 | 0 | 3 |
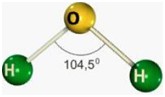
| Angular | 34 | 12 | 22 |
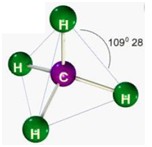
| Tetraédrica | 4 | 0 | 4 |
| Piramidal | 4 | 1 | 3 |
| Bipiramidal | 5 | 0 | 5 |
| Octaétrica | 6 | 0 | 6 |
Obs.: toda molécula biatômica assume geometria linear. E, apenas as geometrias linear, triangular e angular são planas: as outras são espaciais.
Modelos Moleculares
Fontes:
https://web.archive.org/web/20081202052012/http://www.moderna.com.br/pnlem2009mg/quimica/canto/volumes/pdfs/a1_7.pdf
https://web.archive.org/web/20111125073214/http://www.spq.pt:80/boletim/docs/boletimSPQ_103_025_15.pdf
http://pt.wikipedia.org/wiki/Geometria_molecular
http://quimica10.com.br/10/wp-content/uploads/2009/01/10-e28093-geometria-e-polaridade-molecular.pdf
Texto originalmente publicado em https://www.infoescola.com/quimica/geometria-molecular/