A natureza humana impele-nos a justificar todas as informações, de maneira a produzir conhecimento humano, ilustrado pela cultura (cultura “científica”, cultura comportamental, etc.). No campo da química, em especial da Atomística, diversos cientistas procuraram propor modelos explicativos que justificassem os fenômenos observados na natureza. É desta necessidade que advém a teoria dos modelos atômicos, criadas, derrubadas e aprimoradas a partir da observação das “leis naturais” que regem o universo visível e invisível.
Destas observações surgiram diversos modelos atômicos, como o de Dalton, de Thomson, de Rutherford, etc. Como não é intuito discutir a evolução dos modelos atômicos neste momento, basta-nos reconhecer que os números quânticos são conceitos fundamentais evidenciados pelo modelo atômico de Schrödinger. A teoria do modelo atômico de Schrödinger é aceita atualmente e assume a existência de números quânticos conhecidos (s, p, d, f) e também teóricos (g, h, i...), pautando-se em quatro características oriundas da Mecânica Quântica.
A essas quatro características denominaram números quânticos, dos quais se podem enumerar:
- Número quântico principal (n)
- Número quântico secundário ou azimutal (l)
- Número quântico magnético (m ou ml)
- Número quântico spin (S ou ms)
Conteúdo deste artigo
Número quântico principal
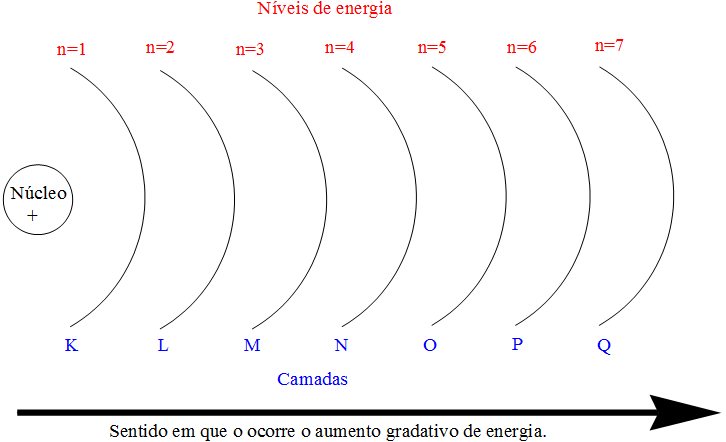
O número quântico principal (n) define o nível de energia ou a camada que os elétrons possuem, definindo também a distância do orbital em relação ao núcleo e o tamanho do orbital ocupado pelo elétron. Tal conceito se assemelha ao conceito de camada, adotado por Niels Böhr e pode ser assim exemplificado:
Número quântico secundário
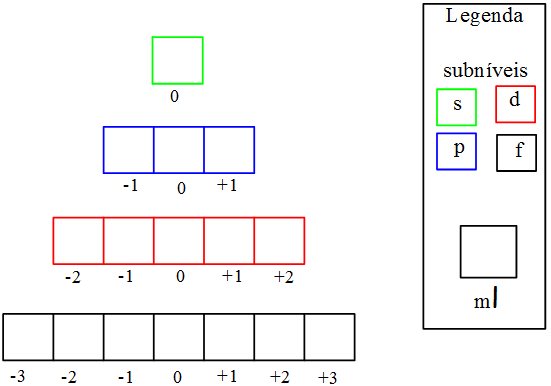
O número quântico secundário (l) é característico por definir o subnível de energia de um elétron. Os valores para l partem do zero ao infinito, mas atualmente têm-se conhecidos poucos subníveis (s, p, d, f). Os subníveis de energia são definidos na Mecânica quântica por: l = n-1; sendo os subníveis listados na seguinte tabela:
| Nível de energia (n) | Valor de l | Subníveis | Subníveis teóricos | Subníveis conhecidos | Número máximo de elétrons* |
| 1 | 0 | 1 | s | s | 2 |
| 2 | 0, 1 | 2 | s, p | s, p | 2+6 = 8 |
| 3 | 0, 1, 2 | 3 | s, p, d | s, p, d | 2+6+10 =18 |
| 4 | 0, 1, 2, 3 | 4 | s, p, d, f | s, p, d, f | 2+6+10+14 = 32 |
| 5 | 0, 1, 2, 3, 4 | 5 | s, p, d, f, g | s, p, d, f | 2+6+10+14 = 32 |
| 6 | 0, 1, 2, 3, 4, 5 | 6 | s, p, d, f, g, h | s, p, d | 2+6+10 = 18 |
| 7 | 0, 1, 2, 3, 4, 5, 6 | 7 | s, p, d, f, g, h, i | s, p | 2+6 = 8 |
* número de elétrons por subnível: s = 2; p = 6; d = 10; f = 14.
A partir da expressão 2n2, é possível calcular a quantidade máxima de elétrons que cada nível pode acomodar, embora esta expressão somente se aplique aos quatro primeiros níveis, em parte pelo desconhecimento dos subníveis subsequentes (g, h, i).
Número quântico magnético
O número quântico magnético (ml) é característico da quantidade de orbitais, para cada subnível. O valor matemático de m é dado por m = ± l. Decompondo este raciocínio, teremos: - l ... 0 ... +l. Os orbitais s, p, d, f estão representados abaixo.
Número quântico spin
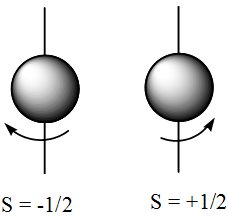
O número quântico Spin (S ou ms) caracteriza o possível movimento rotacional dos elétrons, sob seus eixos imaginários.
Na imagem acima as setas indicam o sentido rotacional do elétron e este movimento influencia no preenchimento dos subníveis, segundo o Princípio da Máxima Multiplicidade (Regra de Hund). Segundo este princípio, o preenchimento dos orbitais deverá se proceder de maneira a manter-se, sempre que possível, o maior número de elétrons desemparelhados. Na figura a seguir, serão analisadas duas tentativas de preenchimento.
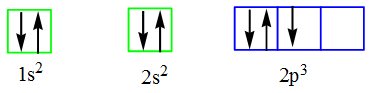
Nitrogênio: N7. Incorreto, pois desconsidera a Regra de Hund ao distribuir os elétrons de maneira emparelhada, restando ainda um orbital vazio.
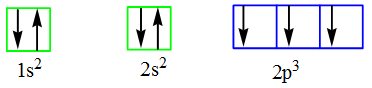
Nitrogênio: N7. Correto, pois considera a Regra de Hund na distribuição dos elétrons (todos desemparelhados).
O emparelhamento só pode ocorrer quando não restarem mais orbitais disponíveis para os elétrons isolados e, devido o Princípio de exclusão de Pauli, somente dois elétrons ocuparão um orbital, sendo a posse de spins opostos, uma condição fundamental à estabilidade dos elétrons.
Referências:
FELTRE, R; YOSHINAGA, S. Atomística – 1ª Ed. – São Paulo: Moderna, 1970. p. 146 – 175.
FELTRE, R. Química Geral – 5ª Ed. – São Paulo: Moderna, 2000. p.110 – 115.
Texto originalmente publicado em https://www.infoescola.com/quimica/numeros-quanticos/