As reações de oxirredução caracterizam-se pela transferência de elétrons entre pelo menos duas espécies envolvidas: a que se oxida (perdendo elétrons - sofrendo aumento do NOx) e a que se reduz (ganhando elétrons - sofrendo redução do NOx). Portanto, um processo é dependente do outro. Entretanto, quando a espécie a ser reduzida (e oxidante) é apenas oxigênio (ou alguma que o contenha na sua molécula, como íon permanganato KMnO4- ou peróxido de hidrogênio H2O2) e/ou um único produto é gerado, usualmente refere-se apenas a nomenclatura oxidação.
Dentre as reações de oxidação pode-se citar as de combustão (sendo o oxigênio o comburente mais utilizado), e as de corrosão (com desgaste de algum metal puro ou liga pela ação do O2 e conseqüente formação de óxidos).
Combustão
Na presença de oxigênio e uma fonte de ignição, um combustível qualquer (gasolina, gás natural, hidrogênio, carvão) sofre oxidação com liberação de energia calorífica; que por sua vez consegue fornecer a energia inicial necessária para que outra parcela de combustível queime, promovendo, então, uma reação em cadeia.
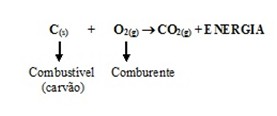
Um exemplo simples de reação de combustão é a oxidação de carvão mineral (considerando apenas carbono puro):
A grande parte dos metais possui tendência a liberar elétrons para se estabilizarem eletronicamente, por isso combinam-se facilmente com espécies oxidantes (como o oxigênio) e reagem de modo que o metal sempre é desgastado (a menos que os óxidos formados diminuam ou inibam esse processo ou que alguma intervenção seja feita, como pintura ou revestimento), assim, sofre corrosão.
Em caldeiras industriais (equipamentos utilizados na geração de vapor d’água), por exemplo, a preocupação sobre a integridade física dos materiais é extremamente recorrente, uma vez que operam sobre altas pressões (dezenas ou centenas de vezes a atmosférica) e qualquer fissura pode causar graves acidentes. Por isso, é necessário remover ao máximo o oxigênio que se encontra dissolvido na água.
De modo resumido, a reação entre o aço (maior componente estrutural de uma caldeira) e o oxigênio é a que se descreve a seguir:
2Fe + O2 → 2FeO
FeO + 2O2 → 2Fe2O3
2FeO + 2Fe2O3 → 2Fe3O4, ou simplesmente, FeO + Fe2O3 → Fe3O4 (magnetita)
Portanto, o ferro pode dar origem aos óxidos de ferro (II) e (III), podendo se combinar e formar a magnetita (“ferrugem”) – deixando o material frágil.
Assim, os chamados sequestrastes de oxigênio são adicionados à água de caldeira de modo a reduzirem a concentração desde gás: o sulfito de sódio é muito utilizado para este fim, como mostra a reação abaixo:
2Na2SO3 + O2 → 2Na2SO4
O oxigênio consegue oxidar ainda mais o enxofre (passando do Nox +4 para +6). Porém, a dosagem deve ser feita com cautela, pois a formação de sulfato de sódio aumenta a quantidade de sólidos dissolvidos e as chances de incrustação nas tubulações.
Fontes:
http://lqa.iqm.unicamp.br/cadernos/caderno1.pdf
http://www.kurita.com.br/adm/download/Sequestrante_de_Oxigenio_Sulfito.pdf
Texto originalmente publicado em https://www.infoescola.com/quimica/oxidacao/