Geralmente as substâncias se dilatam quando aquecidas e contraem quando resfriadas. A água, contudo, não possui este comportamento. De 4 ºC até 100 ºC, a água comporta-se normalmente como qualquer outra substância, aumentando seu volume quando aquecida, mas de 0ºC a 4ºC, ela se contrai ao ser aquecida, ao invés de se dilatar. Aí está o comportamento anômalo da água!
Antes de explicar este comportamento, verifiquemos alguns fatos:
- 1) conforme se aquece a água, seu volume diminui (entre 0ºC e 4ºC);
- 2) conforme se aquece a água, seu volume aumenta (entre 4ºC e 100ºC);
- 3) entre 4ºC e 100ºC a densidade da água diminui, pois seu volume aumenta (a densidade mínima ocorre em 100ºC, quando a água começa se transformar em vapor);
- 4) entre 0ºC e 4ºC a densidade da água aumenta, pois seu volume diminui (a densidade máxima ocorre em 4ºC, onde o seu volume é o menor possível);
Estes quatro fatos podem ser verificados no gráfico a seguir:
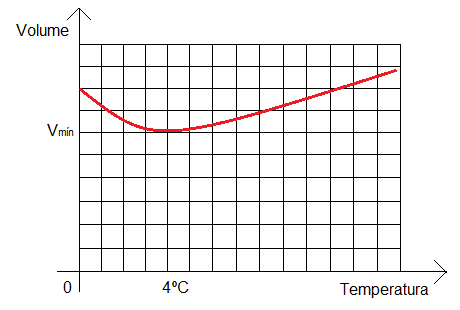
Em 0ºC, temos o estado sólido da água, quando ela se torna gelo. O volume deveria ser mínimo devido ao fato de ser um sólido (moléculas fortemente ligadas). Mas isso não acontece por causa das pontes de hidrogênio que são formadas no estado sólido da água. Elas ocorrem por meio de uma ligação molecular originada da atração de polos negativos e positivos de moleculas diferentes, gerando uma geometria no gelo que exige uma área maior.
Logo, com uma área maior (maior volume), mas com a mesma massa de água, a densidade tende a diminuir, fazendo o gelo flutuar na água.
Ao aquecer a água, há uma agitação maior das moléculas, quebrando as pontes de hidrogênio. Dessa forma, de 0ºC a 4ºC, quando a temperatura começa a aumentar, as pontes começam a ser quebradas, mas em vez de aumentar o volume da água, ele diminui, devido a quebra das pontes, fazendo diminuir a área ocupada por elas.
Ou seja, no estado de gelo o volume era maior do que entre 0ºC e 4ºC. Quando maior parte das pontes são desfeitas em 4ºC, a água tem seu volume mínimo e, a partir desse momento, para de se contrair e tende a se dilatar com o aumento da temperatura, começando o processo normal igual a todas as substâncias.
Este fenômeno, do gelo ter o volume maior (densidade menor) entre 0ºC e 4ºC, faz com que os lagos mantenham uma camada de gelo na superfície, mas a água fica no estado líquido em seu interior, permitindo a vida no ambiente aquático. A convecção ajuda a manter este estado, pois a água mais densa (com temperatura próxima de 4ºC) tende a descer para o fundo do lago, enquanto que a menos densa (próximo a 0ºC) tende a subir, ajudando a formar a camada de gelo na superfície.
Outros exemplos conhecidos por esta característica da água são os icebergs na superfície dos oceanos e o estouro de garrafa com água congelada no refrigerador.
Texto originalmente publicado em https://www.infoescola.com/termodinamica/dilatacao-anomala-da-agua/