Quando um líquido é deixado em repouso observamos o processo de evaporação onde ocorre a vaporização da fase líquida lentamente até que todo material tenha desaparecido. Esse fenômeno faz parte de nossa experiência cotidiana, como por exemplo quando penduramos roupas para secar.
A evaporação ocorre porque a uma dada temperatura existe uma distribuição de velocidade entre as moléculas que compõem o líquido. Algumas moléculas se movem lentamente enquanto outras se movem com grande velocidade. Essas moléculas com energia cinética elevada conseguem vencer as ligações intermoleculares do líquido e escapar para a fase gasosa. O processo causa a perda das moléculas com alta energia cinética resfriando o líquido, a evaporação é portanto um processo endotérmico.
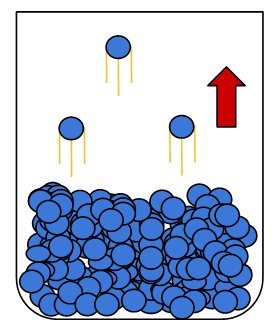
Em um recipiente fechado, no entanto, a mudança de estado será limitada. Enquanto que o processo de moléculas passando da fase líquida para a fase gasosa contínua ocorrendo, o processo inverso também passa a ser importante. As moléculas presas no recipiente voltarão a se chocar contra a superfície do líquido, podendo perder energia na colisão e voltar à fase condensada. Nesse processo a energia cinética das moléculas gasosas é absorvida pelo líquido, portanto a chamada condensação é um processo exotérmico.
Do ponto de vista cinético podemos modelar o fenômeno como dois processo dinâmicos ocorrendo simultâneamente:
- Vaporização cuja taxa depende da temperatura;
- Condensação cuja taxa depende da pressão;
Quando as taxas de vaporização e condensação são iguais dizemos que as fases líquida e gasosa estão em equilíbrio entre si. A pressão exercida pelas moléculas do líquido que foram vaporizadas é chamada de pressão de vapor.
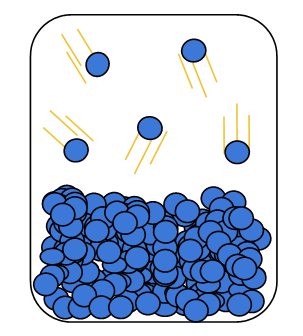
A pressão de vapor depende da natureza do líquido estudado, além de ser fortemente dependente da temperatura. Substâncias com alta pressão de vapor são aquelas com mais facilidade em mudar para a fase gasosa sendo chamadas de substâncias voláteis. Já substâncias com baixa pressão de vapor tem menos facilidade para serem vaporizadas e portanto não são voláteis. A uma determinada temperatura a pressão de vapor do líquido será igual à pressão exterior, quando isso ocorre observa-se que o líquido entra em ebulição. Logo podemos dizer que a temperatura de ebulição de um líquido é aquela em que a pressão de vapor se iguala a pressão externa.
Quando há uma mistura de líquidos em equilíbrio com seus respectivos vapores o comportamento do sistema difere significativamente. Em casos ideais, entretanto, observa-se que a pressão parcial de cada componente é proporcional a sua fração molar no líquido. A constante de proporcionalidade é a pressão de vapor do líquido puro. Essa relação é conhecida como Lei de Raoult e é expressa matematicamente abaixo:
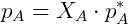
O estudo desse tipo de sistema é muito importante em diversas áreas, como por exemplo para a engenharia química, pois é base das operações de destilação, onde os componentes de uma mistura são separados de acordo com sua volatilidade.
Texto originalmente publicado em https://www.infoescola.com/fisico-quimica/equilibrio-liquido-vapor/