A lei de ação das massas é um modelo matemático utilizado para descrever fenômenos dinâmicos em química, como por exemplo a cinética de reações químicas. A lei diz que a velocidade de uma reação química elementar, isto é uma reação química que ocorre em apenas uma etapa, é proporcional à concentração dos reagentes. Considere a reação hipotética:
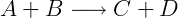
Pela lei a velocidade dessa reação é proporcional às concentrações de A e B. Escrevemos então:
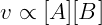
Essa relação é transformada em igualdade introduzindo uma constante de velocidade k, obtemos a chamada lei de velocidade da reação:
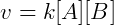
Cada reação tem uma constante de velocidade que depende da temperatura. O coeficiente estequiométrico também é importante na determinação da lei de velocidade, se duas moléculas de uma espécie participam da reação a velocidade depende quadraticamente da concentração desta. Por exemplo, na reação a seguir:
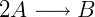
Temos:
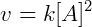
De modo geral podemos escrever a lei de reação como:
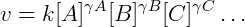
Onde 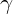 é a ordem da reação de cada reagente. A soma das ordens de todos os reagentes é a ordem global da reação. Para reações elementares a ordem é simplesmente o coeficiente estequiométrico da espécie, que em geral é 1 ou 2, indicando reações unimoleculares e bimoleculares respectivamente. Na prática nem todas reações observadas são elementares, pois são na verdade reações complexas produto de diversas etapas elementares. Nesses casos a ordem de reação não é apenas o coeficiente estequiométrico e deve ser determinada experimentalmente, não havendo restrições quanto ao seu valor, podendo até ser negativa, fracional ou nula.
é a ordem da reação de cada reagente. A soma das ordens de todos os reagentes é a ordem global da reação. Para reações elementares a ordem é simplesmente o coeficiente estequiométrico da espécie, que em geral é 1 ou 2, indicando reações unimoleculares e bimoleculares respectivamente. Na prática nem todas reações observadas são elementares, pois são na verdade reações complexas produto de diversas etapas elementares. Nesses casos a ordem de reação não é apenas o coeficiente estequiométrico e deve ser determinada experimentalmente, não havendo restrições quanto ao seu valor, podendo até ser negativa, fracional ou nula.
É importante notar que a velocidade de uma reação pode ser expressa em relação a qualquer um dos participantes, inclusive produtos. Entretanto, a não ser que os coeficientes estequiométricos sejam iguais, as velocidades vão ser diferentes dependendo da espécie monitorada. Considere a reação:
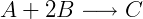
É possível escrever a velocidade de reação como a taxa de variação do componente A:
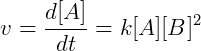
Enquanto uma molécula de A é consumida 2 moléculas de B são consumidas e uma molécula de C é formada, portanto podemos relacionar as taxas de variação da seguinte forma:
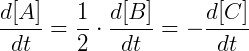
A lei de ação de massas tem implicações cinéticas, descritas acima, e também termodinâmicas, uma vez que o equilíbrio químico pode ser descrito através dessa lei. Sabe-se que o equilíbrio de reações químicas não é estático e sim um equilíbrio dinâmico onde a velocidade da reação direta e inversa são iguais. Isso significa dizer que:
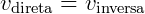
Para uma reação do tipo:
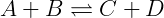
Temos que:
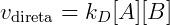
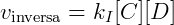
No equilíbrio:
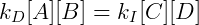
Portanto podemos definir a constante de equilíbrio para esse sistema como:
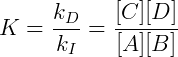
Vemos que pela lei de ação de massas a constante de equilíbrio de uma reação é a razão entre as constantes de velocidade da reação direta e inversa.
Texto originalmente publicado em https://www.infoescola.com/fisico-quimica/lei-de-acao-das-massas/