O elemento químico boro possui número atômico 5 e massa atômica 10,811; e símbolo B. Apresenta densidade igual a 2,34 quando amorfo; quando em estado cristalino, mais puro, é muito duro, apresenta brilho quase metálico e densidade igual a 3,3. Possui ponto de fusão de 2.300º C e volatiliza-se brandamente. Em estado puro o boro não possui muita aplicabilidade, mas na forma de ácido bórico e bórax passa a encontrar grande aplicação na indústria. Na eletrônica, é usado como semicondutor, uma vez que sua condutividade elétrica aumenta com o aumento da temperatura. O boro pode se combinar tanto com elementos metálicos quanto não metálicos, para formando compostos covalentes, já que em nenhum caso dá origem a estados iônicos, cátions (íons de carga positiva) ou ânions (íons de carga negativa).
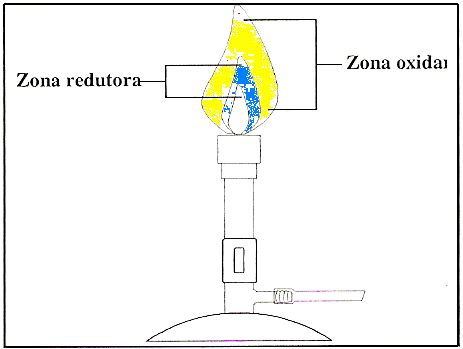
A análise qualitativa emprega dois tipos de ensaio: reações por via seca e reações por via úmida. Reações por via seca são aplicáveis a substâncias sólidas. Essa análise fornece informações úteis em um período de tempo menor. Para os ensaios por via seca é importante conhecer as zonas principais da chama (Figura 1), sendo que na oxidante ocorre combustão completa e na redutora combustão incompleta.
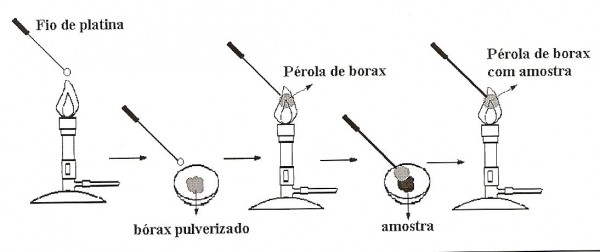
Ensaios na pérola de bórax são desenvolvidos pela formação de pérola de bórax com a substância que contém o metal a ser analisado. O procedimento descrito abaixo requer a utilização de um laboratório de química relativamente bem equipado, sobretudo no que se refere aos reagentes analíticos utilizados.
- Adicionar a um vidro de relógio uma porção de tetraborato de sódio decahidratado (Na4B2O7.10H2O(s).
- Aquecer o fio de platina (o mesmo utilizado na análise da chama), o que deve apresentar uma pequena alça e, ao rubror, rapidamente mergulhar no bórax pulverizado.
- Levar o sólido aderente à região mais quente da chama (oxidante), originando uma pérola incolor transparente (Figura 2).
- Umedecer a pérola e mergulhá-la na substância pulverizada, aderindo uma pequena quantidade de amostra.
- Aquecer essa mistura na chama redutora e observar a coloração da pérola a quente e quando resfriada.
- Repetir item anterior com a zona oxidante.
- O fio de platina é limpo, fundindo a pérola na chama e adicionando-a em recipiente com água. Após, preparar novamente a pérola de bórax para analisar uma nova amostra.
As pérolas produzidas, que originam os boratos dos metais, apresentam coloração característica, conforme tabela abaixo, com os sais de Cu, Fe, Cr, Mn, Co e Ni. O modelo teórico deve ser testado experimentalmente, uma vez que uma série de fatores estão envolvidos nas colorações apresentadas, destacando-se o grau de pureza dos reagentes empregados.
|
METAL |
CHAMA REDUTORA |
CHAMA OXIDANTE |
||
|
A QUENTE |
A FRIO |
A QUENTE |
A FRIO |
|
| cobre | incolor | vermelho-opaco | verde | azul |
| ferro | verde | verde | marrom amarelada ou vermelha | amarela |
| cromo | verde | verde | amarelo escuro | verde |
| manganês | verde | verde | violeta | violeta |
| cobalto | azul | azul | azul | azul |
| níquel | cinza ou preta | cinza ou preta | marrom avermelhada | marrom avermelhada |
Referências:
SARDELLA, Antônio; MATEUS, Edegar; Curso de Química: química geral, Ed. Ática, São Paulo/SP – 1995.
RUSSELL, John B.; Química Geral vol.1, São Paulo: Pearson Education do Brasil, Makron Books, 1994.
MAHAN, Bruce M.; MYERS, Rollie J.; Química: um curso universitário, Ed. Edgard Blucher LTDA, São Paulo/SP – 2002.
Texto originalmente publicado em https://www.infoescola.com/quimica/analise-na-perola-de-borax/