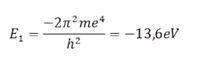No início do século passado, Ernest Rutherford deduziu que um átomo é formado de um núcleo pequeno e denso, onde residem os prótons (cargas positivas) e igual número de elétrons (cargas negativas), habitando a periferia. Este modelo ficou conhecido como modelo planetário ¹.
Embora bastante intuitivo, este modelo para o “átomo” já nasceu “condenado à morte” pois de acordo com a teoria clássica, num átomo como este os elétrons estariam irradiando energia em forma de ondas eletromagnéticas constantemente e em pouco tempo colapsariam sobre o núcleo, aniquilando completamente a matéria.
Além disso, as emissões observadas (se é que seria possível) deveria o ser em todos os comprimentos de onda uma vez que os elétrons descreveriam trajetórias helicoidais contínua emitindo em todas as frequências antes de “caírem” sobre o núcleo.
Foi então que, em 1913, o físico dinamarquês Niels Bohr desenvolveu um novo modelo para explicar a estabilidade da matéria e a emissão do espectro em raias definidas em cada elemento.
Esse modelo embora ainda não “funcionasse” para átomos mais pesados, explicou com perfeição os fenômenos como o espectro de emissão e absorção do hidrogênio. O hidrogênio é o átomo mais simples que existe: seu núcleo tem apenas um próton e só há um elétron orbitando em torno desse núcleo. Para explicar a evidente estabilidade do átomo de hidrogênio e, de quebra, a aparência das séries de linhas espectrais desse elemento,
Bohr propôs alguns "postulados".
1) O elétron gira em torno do núcleo em uma órbita circular, como um satélite em torno de um planeta, mantendo-se nessa órbita às custas da força elétrica atrativa entre cargas de sinais opostos.
2) A órbita circular do elétron não pode ter qualquer raio. Só alguns valores são permitidos para os raios das órbitas.
3) Em cada órbita permitida, o elétron tem uma energia constante e bem definida, dada por: E = E1 / n2, onde E1 é a energia da órbita de raio mínimo. Bohr deu uma fórmula para E1:
Observemos o sinal negativo nessa fórmula. Quanto menor o n, mais interna será a órbita (menor o raio) e mais negativa será a energia do elétron. Os físicos usam energias negativas para indicar que algo está ligado, “confinado” a alguma região do espaço.
4) Enquanto estiver em uma de suas órbitas permitidas, o elétron não emite nem recebe nenhuma energia.
5) Quando um elétron muda de órbita o átomo emite ou absorve um "quantum" de energia luminosa.
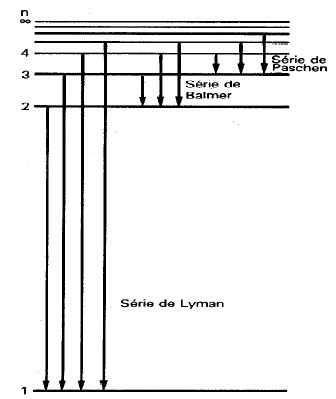
Os níveis de energia são representados como na figura abaixo. Vários cientistas pesquisaram as transições nos diversos níveis. Daí termos várias séries
Notas:
¹ Em 1908, Rutherford realizou sua famosa experiência, que viria a se constituir a sua mais brilhante contribuição (dentre tantas outras) para as ciências Físicas. O experimento consistiu em bombardear com partículas alfa uma folha de ouro muito fina. O experimento mostrou que a grande maioria das partículas atravessava a folha sem se desviar, enquanto outras desviavam. Fundamentado nestas observações e em cálculos, concluiu que os átomos de ouro - e, por extensão, quaisquer átomos – eram estruturas praticamente vazias, e não esferas maciças. Em seu interior estaria concentrada toda a carga positiva, responsável pelo desvio de um pequeno número de partículas alfa. Na periferia desta região, chamada núcleo, orbitam os elétrons. Com isso, o modela elaborado pelo cientista era o de um sistema semelhante ao solar: um núcleo central grande, rodeado de partículas móveis.
Bibliografia:
HALLIDAY, David; RESNICK, Robert; KRANE, Kenneth S.. Física 4. Rio de
Janeiro, LTC – Livro Técnico e Científico, 1996.
TIPLER, Paul. Física: para cientístas e engenheiros. 3ª ed, Vol 4. Rio de Janeiro,
LTC – Livro Técnico e Científico, 1995.
Texto originalmente publicado em https://www.infoescola.com/quimica/atomo-de-hidrogenio-por-niels-bohr/