Um catalisador é uma substância que aumenta a velocidade de uma reação química sem estar sendo consumido por ela. O catalisador não tem efeito sobre o equilíbrio de uma reação, ele pode acelerar ou retardar a velocidade na qual uma reação atinge o equilíbrio, mas ele não afeta a composição no equilíbrio. Seu papel é oferecer uma rota mais rápida para o mesmo destino. Representativamente, colocamos o catalisador em cima da seta que mostra a conversão de reagentes em produtos.
Um exemplo bastante usual de reação catalisada é a decomposição da água oxigenada, que sofre uma decomposição muito lenta em condições ambiente, formando gás oxigênio e água.
H2O2 → O2 + H2O
Ao colocarmos a água oxigenada em um machucado, pode-se observar a formação de bolhas em grande quantidade. Essas bolhas são o gás oxigênio sendo formado rapidamente, ou seja, essa reação foi acelerada ao colocar a água oxigenada em contato com o machucado.
Isso ocorre porque o sangue contém um catalisador biológico para essa reação, chamado de catalase. A catalase é uma enzima presente não só no sangue, mas em diversos outros materiais, como a batata por exemplo.
Em geral, o catalisador acelera a reação encontrando um caminho alternativo (um atalho), que em química traduz-se como um mecanismo de reação diferente, entre reagentes e produtos. Esse novo caminho tem uma energia de ativação menor que a do caminho original.
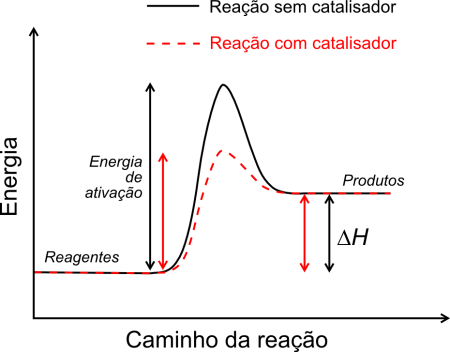
Energia de ativação. Ilustração: Bkell / Wikimedia Commons [adaptado]
A catálise pode ser dividida em dois tipos:
- Catálise Homogênea – quando o catalisador está na mesma fase que os reagentes, ou seja, mesmo estado físico. Por exemplo, para reagentes gasosos, o catalisador também será um gás.
- Catálise Heterogênea – quando o catalisador está em fase diferente dos reagentes. Os catalisadores heterogêneos mais comuns são sólidos, como é o exemplo do catalisador dos automóveis.
Em algumas situações, é comum usar catalisadores com o objetivo de diminuir a velocidade de uma reação. Neste caso, chamamos o catalisador de veneno pois este irá retardar a velocidade de um processo.
Enzimas – Os catalisadores vivos
Os organismos vivos possuem milhares de proteínas que funcionam como catalisadores de reações metabólicas. Esses catalisadores são chamados de enzimas e são moléculas que possuem um sítio ativo parecido com uma cavidade, onde uma reação específica pode ocorrer. O substrato, molécula na qual a enzima age, se encaixa na cavidade como uma chave se encaixa em uma fechadura. Essa especificidade das enzimas diante dos substratos e produtos é muito maior que a da maioria dos catalisadores químicos. Isso quer dizer que uma dada enzima catalisa uma única reação das várias que um único substrato pode sofrer. Na maioria das vezes, as velocidades das reações catalisadas por enzimas têm um aumento da ordem de 106 a 1012 vezes em relação às velocidades das reações não catalisadas.
Bibliografia:
Atkins, P.W., Jones, L., Princípios de química: questionando a vida moderna e o meio ambiente 5ª ed., Porto Alegre: Ed. Bookman, 2012.
Usberco J., Salvador E., Química Geral, 12ª.ed., São Paulo: Saraiva, 2006.
http://www.fcfar.unesp.br/alimentos/bioquimica/enzimas.htm
Texto originalmente publicado em https://www.infoescola.com/quimica/catalisadores/