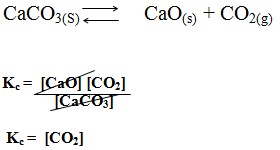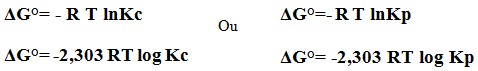A constante de equilíbrio é um valor que relaciona as concentrações das espécies reagentes e do produto no momento em que ocorre o equilíbrio.
Onde Kc representa o valor das constantes de equilíbrio em uma temperatura determinada , em função da concentração da espécies em mol L -1 ou [ ] mol L-1 . Em caso da ocorrência da reação em fase gasosa, a constante é comumente expressa Kp, em função das pressões parciais das espécies presentes no equilíbrio.
Exemplo: Reação onde as espécies apresentam-se em fase gasosa no equilíbrio:
Para a reação genérica a abaixo:
As substâncias presentes no equilíbrio podem estar em diferentes estados físicos (líquido, sólido e/ou gasoso), formando um equilíbrio heterogêneo nesse caso a constante K não considera, as concentrações do líquidos e sólidos puros, uma vez que, nesse contexto a sua variação de concentração será desprezível.
Como exemplos temos a reação de calcinação do Carbonato de Cálcio, dada por:
Como o [CO2] é uma espécie em fase gasosa podemos relacionar as constantes Kc eKp de acordo com equação mencionada a seguir:
Kp = Kc . RT (Δn)
Onde:
- Kp é a constante de equilíbrio em função da pressão.
- Kc é a constante de equilíbrio em função da concentração.
- R é a constante de Clapeyron ou seja R= 0,082 L atm-1
- T é temperatura em Kelvins (K) onde K= T em °C + 273,15
- Δn é a variação do número de mols ou seja Δn = (n produto)-(n reagentes)
Relação das Constantes de equilíbrio e grandezas Termodinâmicas:
A variação de energia livre ΔG de um sistema representa a energia requerida para que seja realizado trabalho útil, em sua mudança de estado. No decorrer da reação observamos que a capacidade de realização de trabalho útil vai gradativamente diminuindo, com o consumo dos reagentes e formação de produto deste modo o sistema atinge o equilíbrio dinâmico, o que mostra que a ΔG tanto dos produtos quanto dos reagentes são iguais fornecendo ΔG=0. De acordo com o diagrama abaixo conclui-se que:
| ΔG= 0 | Sistema atingiu equilíbrio dinâmico |
| ΔG= positiva | A reação ocorre em favor dos reagentes |
| ΔG= negativa | Segue para o estado de equilíbrio |
Ou expressando por meio das equações:
Bibliografia:
Vogel, Arthur Israel, 1905-Química Analítica Qualitativa / Arthur I. Vogel ; [tradução por Antonio Gimeno da] 5. ed. rev. por G. Svehla.- São Paulo : Mestre Jou, 1981 .
James Brady, Humiston Gerard E. QUÍMICA GERAL - VOL. 2 - 2ª EDIÇÃO
Texto originalmente publicado em https://www.infoescola.com/quimica/constante-de-equilibrio/