A grande maioria dos compostos hexacoordenados mostra geometria octaédrica. “Dentre todos os números de coordenação conhecidos, o número de coordenação seis é o mais comum. “Além disso, a partir dele você pode ‘construir’ geometrias como a PBQ e a QP. É Por isso, que muitos exemplos nos diversos livros disponíveis trazem compostos com este número de coordenação”1.
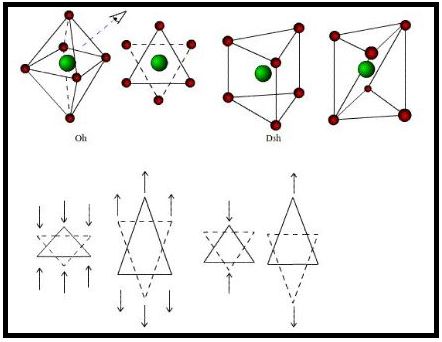
O arranjo molecular octaédrico é bastante simétrico, sendo o ponto de partida para entender outros arranjos deste grupo, que não passam de distorções deste octaedro, em função de fatores resultantes de uma compressão ou alongamento ao longo dos eixos de ordem dois, três ou quatro, como mostrado na Figura 1. Estas distorções podem ser tetragonais, as quais são mais simples, de forma que os ligantes sobre o eixo diferem dos outros quatro restantes, para mais ou para menos, ou ainda pode haver distorções rômbicas, nas quais um ligante trans está mais próximo do átomo central, enquanto o outro está mais afastado. Estas distorções produzem uma grande e ramificada família de isômeros geométricos, que podem variar do simples e estável octaedro a um prisma trigonal (D3h).
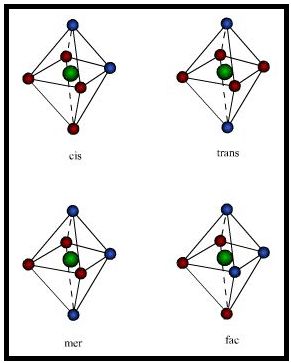
Os compostos com número de coordenação 6, octaédricos, permitem uma variedade de estereoisômeros. Partindo-se do fato de que os seis vértices de um octaedro são equivalentes entre si, apenas uma estrutura torna-se possível para complexos dos tipos MA6 e MA5B. Entretanto, quando se tem dois ligantes diferentes dois demais, os quais podem ser iguais um do outro, como o de fórmula genérica MA4B2, podem então serem possíveis isômeros cis e trans. No caso do isômero cis, os dois ligantes B ocupam os vértices adjacentes do octaedro; no caso do isômero trans, estes estão em vértices opostos, como pode ser visto na Figura 2. Já para os complexos contendo dois ligantes diferentes entre si por duas duplas de ligantes contendo cada uma o mesmo número, como o tipo MA3B3, também são possíveis dois isômeros, denominados então facial (fac) e meridional (mer), conforme pode ser visto também na Figura 2.
Caso o número de ligantes aumente ainda mais, ou, então, caso se considere ligantes polidentados, mais casos de isomerismos geométricos podem ser possíveis, mas estes continuam a ser relacionados pelos prefixos cis, trans, mer, fac, utilizando de uma numeração para explicar a natureza dos casos. Dessa forma, os complexos com número de coordenação seis, os mais comuns, podem ser explicados basicamente por alguns tipos diferentes de isomerias.
Referências:
1. http://www2.ufpa.br/quimdist/disciplinas/quimica_inorganica_teorica/capitulo
Ilustrações: Wikipedia
BARBOSA, Addson Lourenço; Dicionário de Química, A-B Editora, Goiânia/GO – 2000.
SARDELLA, Antônio; MATEUS, Edegar; Curso de Química: química geral, Ed. Ática, São Paulo/SP – 1995.
RUSSELL, John B.; Química Geral vol.1, São Paulo: Pearson Education do Brasil, Makron Books, 1994.
Texto originalmente publicado em https://www.infoescola.com/quimica/estereoquimica-e-isomeria-em-compostos-de-coordenacao-com-nc-6/