Proposta em 1840 pelo químico Germain Henry Hess, a Lei de Hess foi elaborada através de estudos experimentais onde Hess percebeu que a energia liberada por uma reação química não depende da forma com que a reação foi realizada, mas apenas de seu estado inicial e final. Essa observação foi importante na época, pois permitia que reações difíceis de serem estudadas tivessem seus valores de variação de energia calculados.
O calor de uma reação química sob pressão constante é expresso como a variação de entalpia do sistema. Logo, podemos escrever:
qreação = ΔHreação = Hprodutos - Hreagentes
Por convenção quando a variação de entalpia é negativa a reação libera calor e é chamada exotérmica, caso a variação de entalpia seja positiva a reação é endotérmica, absorvendo calor. Uma vez que a entalpia é uma função de estado ela depende apenas dos estados iniciais e finais do sistema e não do caminho que este percorreu. Sabemos hoje então, que a lei de Hess é uma consequência da entalpia ser uma função de estado e da conservação de energia.
Considere a seguinte reação hipotética e sua entalpia:
A+2B → P ΔHI
Imagine que existam duas formas de realizar essa reação, a primeira forma direta como mostrada acima e a segunda através de um intermediário C:
A+B → C ΔHII
B+C → P ΔHIII
Segundo a lei de Hess a variação de entalpia total nos dois casos deve ser igual, pois os estados iniciais e finais são os mesmos. Logo concluímos que:
ΔHII + ΔHIII = ΔHI
Perceba que podemos somar reações químicas para obter uma nova reação. Da mesma forma podemos somar entalpias para obter uma entalpia total. É possível também inverter uma reação, mudando o sinal de ΔH. Como exemplo, considere as seguintes reações de combustão:
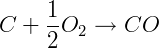
ΔH = -110 kJ/mol
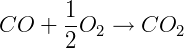
ΔH = -283 kJ/mol
Somando as equações podemos determinar a entalpia de combustão completa do carvão:
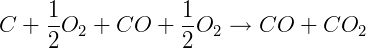
ΔH = -110 kJ/mol - 283 kJ/mol
Simplifica-se a expressão removendo compostos que aparecem tanto nos produtos quanto nos reagentes e somando os coeficiente dos que aparecem duplicados no mesmo lado:
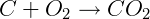
ΔH = -393 kJ/mol
Em química existem infinitas reações que podem ser estudadas. Ao invés de criar tabelas de ΔH para várias reações definiu-se o conceito de entalpia padrão de formação. A entalpia padrão de formação de um composto é a variação de entalpia envolvida na formação dessa substância, em condições padrão, partindo de seus elementos em suas formas mais comuns. As reações de formação de algumas substâncias são apresentadas a seguir.
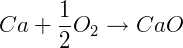
ΔHºf CaO = -635,09 kJ/mol
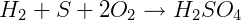
ΔHºf H2SO4 = -909,27 kJ/mol
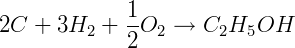
ΔHºf C2H5OH = -277,69 kJ/mol
Conhecendo as entalpias de formação dos reagentes e produtos é possível determinar a variação de entalpia de qualquer reação utilizando a Lei de Hess.
Referencia:
ATKINS, P. W.; PAULA, Julio de. Físico-química. 8. ed. Rio de Janeiro: LTC, 2008. 2 v. ISBN 9788521616009 (v.1).
Texto originalmente publicado em https://www.infoescola.com/quimica/lei-de-hess/