A eletronegatividade é uma propriedade que resulta da ação conjunta da energia de ionização e da eletroafinidade, e pode ser definida como a propriedade pela qual o átomo apresenta maior ou menor tendência em atrair elétrons para si. Já Linus Pauling definiu o termo eletronegatividade como sendo “o poder de um átomo, em uma molécula, de atrair elétrons elétrons em direção a seu núcleo”1. Já de acordo com outro autor, “a eletroafinidade consiste em um extensão de conceitos da termoquímica, desenvolvidos no século passado por Berthelot. A escala de eletronegatividade divide os elementos em metais e não-metais, em torno, aproximadamente, do hidrogênio. Os valores são expressos na unidade de elétron-volt e variam de 0,7 para o césio que é o menos eletronegativo, a 4,0 para o flúor, que é o elemento que possui maior poder de atração sobre os elétrons”2.
Esta propriedade está na dependência de dois fatores: o número de elétrons na última camada e o tamanho do átomo. O primeiro fator – número de elétrons na última camada – exerce influência direta na eletronegatividade do átomo, pois quanto mais próximo os átomos estiverem de atingir a estabilidade (preenchimento de sua camada mais externa) maior será sua avidez por elétrons, ou seja, maior será sua eletronegatividade.
O segundo fator – tamanho do átomo – é de extrema importância na eletronegatividade, pois quanto menor é o átomo, maior é a atração que seu núcleo exerce sobre elétrons periféricos e, portanto, maior é sua eletronegatividade.
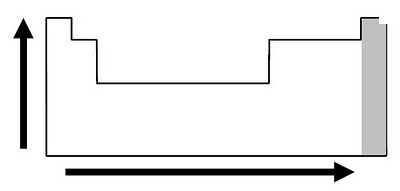
Átomos pequenos atraem elétrons mais eficazmente do que átomos grandes. Isso se deve ao fato dos átomos pequenos possuírem seus núcleos menos “protegidos” por suas camadas eletrônicas. E como o tamanho do átomo aumenta nas famílias da tabela periódica de cima para baixo, concluímos que a eletronegatividade aumentará de baixo para cima.
Já nos períodos da tabela periódica pode-se verificar que esse aumento se dá da esquerda para a direita, pois sabe-se que o tamanho do átomo aumenta da direita para a esquerda. Pode-se ver a variação da eletronegatividade nas famílias e períodos da tabela periódica na Figura 1.
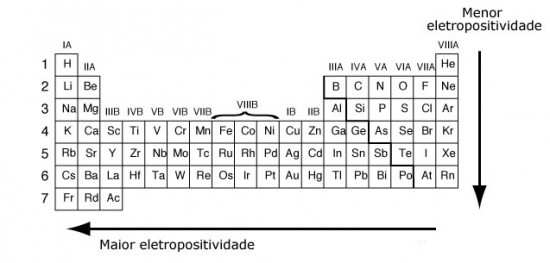
Já o oposto da Eletronegatividade, a “eletropositividade é a propriedade pela qual o átomo apresenta maior ou menor tendência em repelir elétrons”3, ou seja, “é a propriedade que mede a facilidade que um átomo maior tem de ceder elétrons a outro átomo menor”2.
Esta característica corresponde ao inverso da eletronegatividade e, portanto, sua variação nas famílias da tabela periódica tem um aumento de cima para baixo e nos períodos da direita para a esquerda, conforme mostra a Figura 2.
Referências:
1. JONES, Chris J.; A Química dos Elementos dos Blocos d e f, Sociedade Brasileira de Química, Bookman, São Paulo/SP – 2002.
2. BARBOSA, Addson Lourenço; Dicionário de Química, A-B Editora, Goiânia/GO – 2000.
3. SARDELLA, Antônio; MATEUS, Edegar; Curso de Química: química geral, Ed. Ática, São Paulo/SP – 1995.
Texto originalmente publicado em https://www.infoescola.com/quimica/tendencia-do-atomo-em-atrair-ou-repelir-eletrons/