Com base na formação de um complexo de coordenação, a teoria do campo cristalino propõe que a interação entre os ligantes e o íon metálico central é de natureza estritamente eletrostática e ainda prevê que os níveis de energia nos orbitais d do íon metálico perdem a degenerescência, isto é, não permanecem com a mesma energia entre si, devido ao efeito produzido pelo campo elétrico com a aproximação dos ligantes.
“Os compostos de coordenação contem íons complexos, nos quais os ligantes formam ligações coordenadas com o metal Assim, o ligante deve ter um par de elétrons livres e o metal um orbital vazio. A teoria permite determinar quais são os orbitais atômicos do metal que são utilizados para formar as ligações.Prevê o numero de elétrons desemparelhados, porem não explica a cor dos complexos e as propriedades magnéticas em função da temperatura”.1
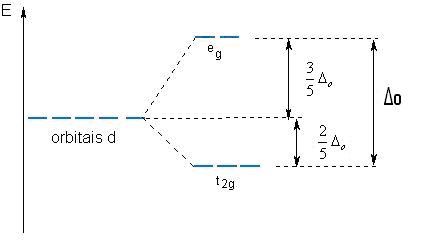
Alguns orbitais d concentram-se em regiões mais próximas dos ligantes que os outros, e os elétrons ocuparão os orbitais que estiveram mais longe do ligante, conforme pode ser visto na Figura 1. Neste caso considerando os orbitais denominados dz² e dx²-y² com lobos mais localizados nas vizinhanças dos ligantes e os orbitais denominados dxy , dxz, dyz com lobos entre os ligantes obtém-se o seguinte diagrama com base na diferença entre os níveis de energia:
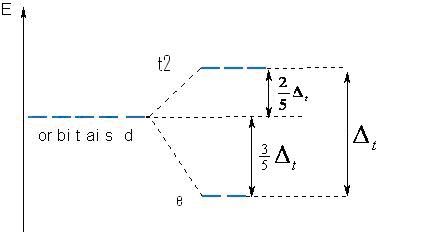
Os orbitais dz² e dx²-y², com energias mais altas, são denominados de orbitais eg, enquanto os orbitais dxy, dzx, dyz denominados t2g, que apresentam menor energia, e Δ0 o – parâmetro de desdobramento do campo ligante - está associado à diferença de energia entre os dois níveis, t2g e eg. Com raciocínio semelhante, analisando agora uma estrutura tetraédrica, observa-se que os orbitais dxy , dzx, dyz ficariam menos estáveis que os orbitais dz² e dx²-y², já que estes últimos não estão tão próximos à direção de aproximação dos ligantes. Dessa forma, o para sistemas tetraédricos é mostrado na Figura 2.
Alguns complexos costumam desviar-se da geometria octaédrica e também da geometria tetraédrica, apresentando distorções tetragonais, como por exemplo, complexos hexacoordenados de cobre(II). Essa distorção é conhecida por distorção Jahn-Teller, e corresponde a uma extensão ao longo do eixo z e uma compressão ocorrida nos eixos x e y. Dessa forma, todos os orbitais que tem componente em z se estabilizam e os restantes se desestabilizam.
Referências:
1. http://www.artigonal.com/quimica-artigos/compostos-de-coordenacao
ATKINS, Peter; JONES, Loreta; Princípios de Química: questionando a vida moderna e o meio ambiente, Porto Alegre: Bookman, 2001.
BARBOSA, Addson Lourenço; Dicionário de Química, A-B Editora, Goiânia/GO – 2000.
EPSTEIN, Lawrence M.; ROSENBERG, Jerome l.; Química Geral, (Coleção Schaum), Porto Alegre: Bookman, 2003.
Texto originalmente publicado em https://www.infoescola.com/quimica/teoria-do-campo-cristalino-e-distorcao-jahn-teller/