O Teste da Chama é um importante método de identificação, principalmente de cátions metálicos, utilizado na análise química. Neste ensaio, ocorrem as interações atômicas através dos níveis e subníveis de energia quantizada. “Quando um objeto é aquecido, ele emite radiação, que pode ser observada através da sua cor. Um exemplo é o aquecimento de metais nas indústrias metalúrgicas, quando eles emitem uma cor vermelha intensa”1.
Considerando o átomo de potássio, onde 19K = 1s2 2s2 2p6 3s2 3p6 4s1, o elétron 4s1 é o mais externo, sendo que este pode ser facilmente elevado para o 4p, ocorrendo a excitação eletrônica. O elétron excitado apresenta tendência a voltar a seu estado normal, 4s1, emitindo um quantum de energia (fóton), que é uma quantidade de energia bem definida e uniforme. Neste caso obtemos uma coloração violeta da chama.
“De forma simplificada, observa-se que quando um elétron recebe energia ele salta para uma orbita mais externa. E a quantidade pacote de energia absorvida e bem definida (quantum) que é equivalente á diferença energética entre as camadas. E quando um elétron esta no estado excitado ele volta para a sua orbita estacionaria ele libera energia na forma de ondas eletromagnéticas (luz) de frequência característica do elemento desse átomo. Bohr então propõe que o átomo só pode perder energia em certas quantidades discretas e definidas, e isso sugere que os átomos possuem níveis com energia definida. Essas teorias de Bohr hoje são comprovadas a partir de cálculos e experimentos. Entre eles esta o teste da chama”2..
OBS: A amostra deve entrar em contato com a zona redutora da chama, sendo a coloração obtida na zona oxidante.
PROCEDIMENTO EXPERIMENTAL:
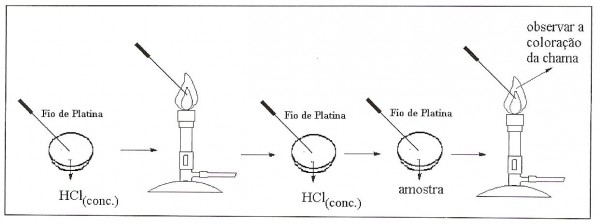
- Coloque o ácido clorídrico em um tubo de ensaio. Sempre trabalhe com HCl concentrado em capela.
- Acenda o bico de Bunsen e, com o auxílio da pinça de madeira, leve o fio de níquel-crômo ao fogo até que a chama não mude mais de cor.
- Caso haja presença de cor na chama, mergulhe a ponta do fio no ácido clorídrico.
- Passe a ponta do fio no cloreto de potássio, leve-o à chama e observe.
- Limpe o fio mergulhando-o novamente no ácido clorídrico.
- Repita o processo com os demais sais.
Na figura abaixo tem-se o procedimento experimental explicitado, na qual pode-se ver a sequência destes.
OBSERVAÇÕES:
- Podem-se usar outros sais que apresentem estes mesmos cátions, desde que não sejam tóxicos ou possam causar algum tipo de dano à integridade física dos operadores.
- O cloreto de sódio normalmente contamina as demais amostras, adulterando os resultados; por este motivo, deve ser deixado por último.
- As cores que devem ser obtidas nos ensaios são:
- sódio – amarelo-alaranjado.
- potássio – violeta-pálido
- cálcio – vermelho-alaranjado
- estrôncio – vermelho-sangue
- bário – verde-amarelado
- cobre – verde-azulado
Leia também:
Referências:
1. www.ebah.com.br/content/ABAAAAl2oAF/teste-chama-transicao-cores
2. www.ebah.com.br/content/ABAAABujcAH/teste-chama
RUSSELL, John B.; Química Geral vol.1, São Paulo: Pearson Education do Brasil, Makron Books, 1994.
Texto originalmente publicado em https://www.infoescola.com/quimica/teste-da-chama/