Para uma certa quantidade de gás existem três variáveis que definem completamente seu estado: a temperatura, o volume e a pressão. Essas variáveis não são independentes entre si, portanto a mudança em uma delas necessariamente afetará as outras. A Lei de Boyle-Mariotte (geralmente chamada apenas de Lei de Boyle) discorre sobre como as mudanças no volume afetam a pressão, e vice versa, sob uma temperatura constante.
Historicamente, a relação entre volume e pressão foi estudada primeiramente por Robert Boyle que apresentou seus resultados em seu livro "New Experiments physicomechanicall, touching the Spring of the Air" publicado em 1660, entretanto a formulação matemática conhecida hoje foi proposta em 1661 por Richard Towneley e Henry Power. Edme Mariotte publicou trabalhos semelhantes somente quatorze anos depois de Boyle.
A formulação matemática da lei diz que sob temperatura constante o produto da pressão e volume de um gás é constante. Isto é:
PV = constante
Podemos então avaliar como a mudança no volume afeta a pressão estudando a expressão:
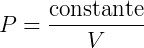
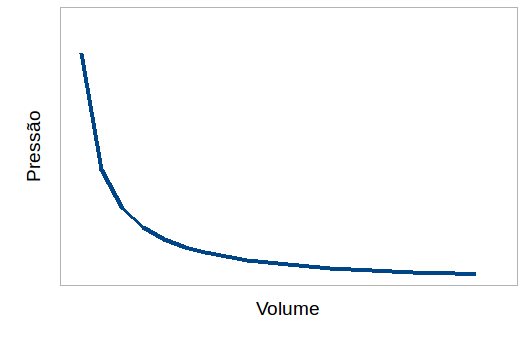
Outra forma de enunciar isso é dizer que volume e pressão são inversamente proporcionais. O perfil dessa expressão pode ser visto no gráfico a seguir:
A grande utilidade da lei de Boyle é a possibilidade de prever o comportamento de sistemas submetidos a transformações isotérmicas, isto é, transformações onde a temperatura é mantida constante. Nesse caso podemos relacionar o estado inicial e final do gás da seguinte forma:
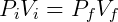
A expressão acima permite que, conhecendo o estado inicial do gás, determine-se a pressão ou volume final. Por exemplo, podemos examinar o efeito na pressão quando o volume de um gás é reduzido pela metade. Nesse caso:
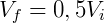
Logo,
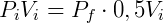
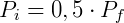
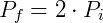
Portanto reduzindo o volume pela metade fará com que a pressão seja dobrada. De forma análoga podemos analisar o efeito inverso, o que ocorre com a pressão caso dobremos o volume.
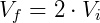
Temos então que:
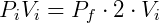
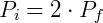
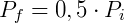
Nesse caso verifica-se uma queda da pressão, que será metade da pressão inicial.
Esses exemplos evidenciam a informação principal da Lei de Boyle-Mariotte, sob condições isotérmicas pressão e volume são inversamente proporcionais, qualquer acréscimo em um deles irá causar um decréscimo proporcional no segundo. Desta forma o entendimento dessa lei ajuda na obtenção de intuição a respeito do comportamento de gases, além de ser uma peça chave na elaboração da lei dos gases ideias, que encaixa todos os estudos sobre sistemas gasosos em uma expressão mais geral.
Referencias:
Hawthorne, R. M. Boyle's/Hooke's/ Towneley and Power's/Mariotte's Law. J. Chem. Educ., 1979, 56 (11), p 741.
Texto originalmente publicado em https://www.infoescola.com/termodinamica/lei-de-boyle-mariotte/