Sem dúvida o carbono é um elemento químico extremamente importante, por ser indispensável à existência da vida - seja ela animal e vegetal - sem falar dos compostos minerais constituídos pelo elemento em questão. O elemento não-metálico tetravalente carbono, está localizado na família 4A da tabela periódica, apresenta o numero atômico 6 e massa atômica 12, e símbolo C.
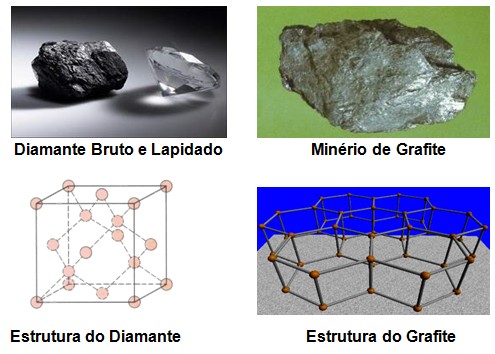 Foi descoberto na antiguidade, a sua união com outros elementos para formação de compostos e moléculas é chamada de ligação covalente, ou seja, o carbono compartilha seus elétrons com os demais elementos ligando-se tetraedricamente com os quais tem afinidade eletrônica, exceto em algumas ocasiões. Sua presença na natureza ocorre em duas formas alotrópicas: o diamante e a grafite. O diamante é um sólido covalente que apresenta dureza e ponto de ebulição bastante elevado e o material mais duro existente enquanto que a grafite é menos resistente.
Foi descoberto na antiguidade, a sua união com outros elementos para formação de compostos e moléculas é chamada de ligação covalente, ou seja, o carbono compartilha seus elétrons com os demais elementos ligando-se tetraedricamente com os quais tem afinidade eletrônica, exceto em algumas ocasiões. Sua presença na natureza ocorre em duas formas alotrópicas: o diamante e a grafite. O diamante é um sólido covalente que apresenta dureza e ponto de ebulição bastante elevado e o material mais duro existente enquanto que a grafite é menos resistente.
Normalmente a maior parte do carbono presente na natureza está na forma de compostos, principalmente nos compostos orgânicos que apresentam o esqueleto de suas cadeias compostas por este elemento. O carbono é tão essencial para existência de vida que o DNA, as proteínas e outros compostos importantes para a vida são formados por cadeias carbônicas, entre outros compostos amplamente estudados pela bioquímica.
A Química Orgânica é o ramo da química que se ocupa exclusivamente do estudo do carbono e de seus compostos, isto não quer dizer que não existam compostos carbônicos inorgânicos, como veremos seguir. Está presente em todo o reino animal e vegetal formando os compostos essenciais para a vida. Em minerais, este se encontra na forma carbonatos, carbetos e bicarbonatos.
A presença do carbono é cotidiana, e observa-se isso pelos compostos cujo, as suas formulas químicas são formadas por um esqueleto carbônico tais como a celulose das nossas roupas e do papel, dos plásticos e dos nossos alimentos e até mesmo os números e pesos atômicos tem como referencia a massa atômica do carbono de acordo com a convenção de 1977 da comissão de pesos atômicos da IUPAC.
Além do diamante e do grafite citado acima o carbono apresenta uma outra forma alotrópica descoberta em 1985 chamada fulereno com moléculas formando estruturas com 60 átomos de C, batizado com este nome em homenagem ao arquiteto R. Buckminister Fuller.
Informações importantes:
- Símbolo: C
- Massa Atômica: 12 u
- Número atômico: 6
- Ponto de Fusão: 3550°C
- Ponto de Ebulição:4289°C
- Formas alotrópicas: Diamante e grafite.
- Configuração Eletrônica: 1s², 2s², 2p²
- Hibridização: sp³

Alguns Compostos de Carbono:
CH4, Na2CO3, C2H6, C2H5OH, CaC2
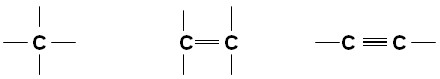
Ligações de estruturas carbônicas mais comuns:
Bibliografia:
https://web.archive.org/web/20200117072802/http://nautilus.fis.uc.pt:80/st2.5/scenes-p/elem/e00610.html
https://web.archive.org/web/20100130073913/http://www.cdcc.sc.usp.br:80/elementos/carbono.html
QUÍMICA - UM CURSO UNIVERSITÁRIO / Mahan, Bruce M / Myers, Rollie J.- 2002 – 4° ed.
James Brady, Humiston Gerard E. QUÍMICA GERAL - VOL. 2 - 2ª EDIÇÃO
Texto originalmente publicado em https://www.infoescola.com/elementos-quimicos/carbono/