A calcinação é um procedimento endotérmico realizado afim de remover compostos voláteis em uma amostra, oxidar matéria orgânica, melhorar a condutividade elétrica, alterar a estrutura cristalina de determinadas substâncias, produzir óxidos, realizar a decomposição térmica e remover impurezas indesejadas. Os compostos voláteis que saem da amostra durante o processo são comumente água, gases como oxigênio e gás carbônico, solventes, etc. Trata-se de uma reação de decomposição térmica a que ocorre durante o processo de calcinação, que é aplicado em compostos sólidos, com temperatura em torno de 1000°C.
O procedimento pode ser realizado em laboratório, utilizando-se de equipamentos e vidrarias relativamente simples. Utiliza-se um forno mufla elétrico, bico de Bunsen, balança analítica ou semi - analítica, cadinhos de porcelana, dessecador, pinça para cadinho e estufa.
Industrialmente a calcinação é realizada em fornos a óleo, em temperaturas extremamente altas, alterando as propriedades físicas e químicas da amostra de interesse, é utilizado em diversos ambientes industriais, como por exemplo, refinarias de petróleo, mineradoras, industrias de reciclagem, usinas cimenteiras, fabricação de óxidos e na indústria de papel e celulose.
Conteúdo deste artigo
Breve histórico
A calcinação foi originalmente desenvolvida para se referir a processos que utilizam o cálcio, como a transformação do calcário em cal, que justifica o nome dado ao método, e este método era utilizado no Egito Antigo, pelos Maias, Moguls e Incas, e na Roma Antiga. Em processos analíticos, os alquimistas do Século XVIII utilizavam a calcinação para obtenção de cinzas de plantas medicinais e da famosa Pedra Filosofal, que os alquimistas da Idade Média acreditavam ser capaz de transformar qualquer metal em ouro, realizar transmutações em animais e até produzir o “Elixir da Longa Vida”, que eles acreditavam que traria vida eterna.
Exemplos de Calcinação
O processo de calcinação pode ser aplicado em amostras de compostos sólidos, normalmente visando a decomposição térmica da amostra de interesse, em compostos como os exemplos abaixo:
- Decomposição de Carbonatos;
- Decomposição de Hidratos em minerais;
- Decomposição de compostos voláteis em material orgânico;
- Tratamento térmico para obtenção de óxidos;
Curiosidade: como é feita a calcinação da Cal?
Sabemos que este método tem seu nome baseado nos processos de calcinação do calcário para obtenção de cal. Vamos ver como esse processo ocorre na indústria.
Primeiramente é feita a extração de rochas de calcário, em seguida passa por uma seleção das rochas de interesse e estas são trituradas e moída. O calcário já moído é então submetido à elevadas temperaturas, em torno de 900 a 1000°C em fornos industriais, e passa então pelo processo de calcinação para formação do óxido de cálcio, ou, popularmente conhecida como cal virgem (CaO). Para a obtenção da cal hidratada, produto muito utilizado na agricultura e na construção civil, o óxido de cálcio passa por uma reação de hidratação, conforme equação química abaixo:
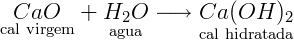
Referências:
http://www.ct.ufrgs.br/ntcm/graduacao/ENG06632/Calcinacao.pdf
http://www.manutencaoesuprimentos.com.br/conteudo/5209-como-funciona-a-calcinacao/
https://pt.wikipedia.org/wiki/Pedra_filosofal
http://www.fiepr.org.br/sindicatos/sindicalpr/historico-1-3302-19867.shtml
http://www.calcinacaomax.com.br/qualidade/processo-de-calcinacao-da-cal
Texto originalmente publicado em https://www.infoescola.com/quimica/calcinacao/